Chlorid ceritý
| Chlorid ceritý | |
|---|---|
 Vzorek chloridu ceritého | |
| Obecné | |
| Systematický název | chlorid ceritý |
| Anglický název | Cerium(III) chloride |
| Sumární vzorec | CeCl3 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 7790-86-5 |
| PubChem | 24636 |
| SMILES | [Cl-].[Cl-].[Cl-].[Ce+3] |
| InChI | 1S/Ce.3ClH/h;3*1H/q+3;;;/p-3á látks |
| Vlastnosti | |
| Molární hmotnost | 246,48 g/mol (bezvodý) 372,58 g/mol (heptahydrát) |
| Teplota tání | 817 °C (1 090 K) (bezvodý) |
| Teplota varu | 1 727 °C (2 000 K) |
| Teplota rozkladu | 90 °C (363 K) (heptahydrát) |
| Hustota | 3,97 g/cm3 |
| Rozpustnost ve vodě | 100 g/100 ml |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu a acetonu |
| Struktura | |
| Krystalová struktura | šesterečná (typ UCl3) |
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). Některá data mohou pocházet z datové položky. | |
Chlorid ceritý (CeCl3) je sloučenina ceru a chloru; hygroskopická pevná látka. Na vzduchu rychle pohlcuje vlhkost za vzniku hydrátu proměnlivého složení. Je velmi dobře rozpustný ve vodě a v bezvodé formě také v ethanolu a acetonu.[1]
Příprava bezvodého CeCl3
Samotné zahřívání hydrátu může vést k hydrolýze.[2]
V použitelné podobě lze chlorid ceritý získat pozvolným, několikahodinovým, zahříváním heptahydrátu na 140 °C ve vakuu.[1][3][4] V něm se může nacházet malé množství CeOCl vzniklého hydrolýzou, ovšem je možné jej použít společně s organolithnými i Grignardovými činidly. Čistý bezvodý CeCl3 je možné připravit z hydrátu dehydratací pomalým zahříváním na 400 °C za přítomnosti 4- až 6násobného množství chloridu amonného ve vysokém vakuu[2][5][6][7] nebo zahříváním s přebytkem chloridem thionylu po 3 hodiny.[2][8]
Dalším způsobem přípravy bezvodého chloridu ceritého je reakce kovového ceru s kyselinou chlorovodíkovou.[9][10]
Přečištění se většinou provádí sublimací za vysoké teploty ve vysokém vakuu.
Použití
Chlorid ceritý je možné použít jako výchozí látku na přípravu dalších ceritých solí, jako například trifluormethansulfonátu ceritého, Lewisovy kyseliny používané při Friedelových-Craftsových acylacích a jako katalyzátor při Friedelových-Craftsových alkylacích.[11]
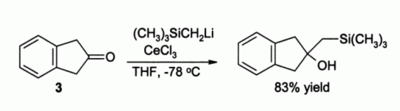
V Lucheově redukci[12] α,β-nenasycených karbonylových sloučenin, často využívané v organické syntéze, se používá CeCl3·7H2O společně s tetrahydridoboritanem sodným; například z karvonu vzniká pouze allylový alkohol 1 a ne nasycený alkohol 2. Za nepřítomnosti CeCl3 vzniká směs obou těchto alkoholů.

Další významné využití v organické syntéze nalézá chlorid ceritý při alkylaci ketonů, kde při použití organolithných sloučenin vznikají enoláty; například sloučenina 3 se za nepřítomnosti CeCl3 přemění na samotný enolát, zatímco je-li přítomen CeCl3, tak dojde k alkylaci:
Bylo zjištěno, že organolithné sloučeniny jsou při této reakci účinnější než Grignardova činidla.[3]
Reference
V tomto článku byl použit překlad textu z článku Cerium(III) chloride na anglické Wikipedii.
- ↑ a b PAQUETTE, L. A. Handbook of Reagents for Organic Synthesis: Reagents, Auxiliaries and Catalysts for C-C Bond Formation. Redakce Coates, R. M.. New York: Wiley, 1999. ISBN 0-471-97924-4. Je zde použita šablona
{{Cite book}}označená jako k „pouze dočasnému použití“. - ↑ a b c EDELMANN, F. T.; POREMBA, P. Synthetic Methods of Organometallic and Inorganic Chemistry. Redakce Herrmann, W. A.. Stuttgart: Georg Thieme Verlag, 1997. ISBN 3-13-103021-6. Je zde použita šablona
{{Cite book}}označená jako k „pouze dočasnému použití“. - ↑ a b JOHNSON, C. R.; TAIT, B. D. A cerium(III) modification of the Peterson reaction: methylenation of readily enolizable carbonyl compounds. Journal of Organic Chemistry. 1987, s. 281–283. ISSN 0022-3263. DOI 10.1021/jo00378a024. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“. - ↑ DIMITROV, Vladimir; KOSTOVA, KALINA; GENOV, MIROSLAV. Anhydrous cerium(III) chloride — Effect of the drying process on activity and efficiency. Tetrahedron Letters. 1996, s. 6787–6790. DOI 10.1016/S0040-4039(96)01479-7. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“. - ↑ TAYLOR, M. D.; CARTER, P. C. Preparation of anhydrous lanthanide halides, especially iodides. Journal of Inorganic and Nuclear Chemistry. 1962, s. 387–391. DOI 10.1016/0022-1902(62)80034-7. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“. - ↑ KUTSCHER, J.; SCHNEIDER, A. Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden. Inorg. Nucl. Chem. Lett.. 1971, s. 815. DOI 10.1016/0020-1650(71)80253-2. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“. - ↑ GREENWOOD, N. N.; EARNSHAW, A. Chemistry of the Elements. New York: Pergamon Press, 1984. ISBN 0-08-022056-8. Je zde použita šablona
{{Cite book}}označená jako k „pouze dočasnému použití“. - ↑ FREEMAN, J. H.; SMITH, M. L. The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride. Journal of Inorganic and Nuclear Chemistry. 1958, s. 224–227. DOI 10.1016/0022-1902(58)80073-1. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“. - ↑ DRUDING, L. F.; CORBETT, J. D. Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide. Journal of the American Chemical Society. 1961, s. 2462–2467. ISSN 0002-7863. DOI 10.1021/ja01472a010. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“. - ↑ CORBETT, J. D. Rev. Chim. Minerale. 1973, s. 239. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“. - ↑ MINE, Norioki; FUJIWARA, YUZO; TANIGUCHI, HIROSHI. Trichlorolanthanoid (LnCl3)-catalyzed Friedel-Crafts alkylation reactions. Chemistry Letters. 1986, s. 357–360. DOI 10.1246/cl.1986.357. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“. - ↑ LUCHE, Jean-Louis; RODRIGUEZ-HAHN, LYDIA; CRABBÉ, PIERRE. Reduction of natural enones in the presence of cerium trichloride. Journal of the Chemical Society, Chemical Communications. 1978, s. 601–602. DOI 10.1039/C39780000601. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid ceritý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid ceritý na Wikimedia Commons
| Chloridy s prvkem v oxidačním čísle III. | |
|---|---|
| Chlorid hlinitý (AlCl3) • Chlorid antimonitý (SbCl3) • Chlorid arsenitý (AsCl3) • Chlorid boritý (BCl3) • Chlorid bismutitý (BiCl3) • Chlorid ceritý (CeCl3) • Chlorid chromitý (CrCl3) • Chlorid erbitý (ErCl3) • Chlorid europitý (EuCl3) • Chlorid gadolinitý (GdCl3) • Chlorid gallitý (GaCl3) • Chlorid holmitý (HoCl3) • Chlorid inditý (InCl3) • Chlorid iriditý (IrCl3) • Chlorid železitý (FeCl3) • Chlorid lanthanitý (LaCl3) • Chlorid lutecitý (LuCl3) • Chlorid neodymitý (NdCl3) • Chlorid niklitý (NiCl3) • Chlorid niobitý (NbCl3) • Chlorid joditý (I2Cl6) • Chlorid dusitý (NCl3) • Chlorid fosforitý (PCl3) • Chlorid promethitý (PmCl3) • Chlorid praseodymitý (PrCl3) • Chlorid plutonitý (PuCl3) • Chlorid rhoditý (RhCl3) • Chlorid rhenitý (ReCl3) • Chlorid ruthenitý (RuCl3) • Chlorid samaritý (SmCl3) • Chlorid skanditý (ScCl3) • Chlorid terbitý (TbCl3) • Chlorid thallitý (TlCl3) • Chlorid thulitý (TmCl3) • Chlorid titanitý (TiCl3) • Chlorid uranitý (UCl3) • Chlorid wolframitý (WCl3) • Chlorid vanaditý (VCl3) • Chlorid ytterbitý (YbCl3) • Chlorid yttritý (YCl3) • Chlorid zlatitý (AuCl3) • Chlorid zirkonitý (ZrCl3) • Chlorid americitý (AmCl3) • Chlorid kobaltitý (CoCl3) | |
| Anorganické soli cerité | |
|---|---|
| Halogenidy a pseudohalogenidy | |
| Soli kyslíkatých kyselin (neuvedeny soli | Chlorečnan ceritý (Ce(ClO3)3) • Chloristan ceritý (Ce(ClO4)3) • Bromičnan ceritý (Ce(BrO3)3) • Jodičnan ceritý (Ce(IO3)3) • Orthojodistan ceritý (Ce5(IO6)3) • Metajodistan ceritý (Ce6I4O23) • Siřičitan ceritý (Ce2(SO3)3) • Síran ceritý (Ce2(SO4)3) • Dithionan ceritý (Ce2(S2O3)3) • Seleničitan ceritý (Ce2(SeO3)3) • Selenan ceritý (Ce2(SeO4)3) • Dusičnan ceritý (Ce(NO3)3) • Fosforečnan ceritý (CePO4) • Hydrogenfosforečnan ceritý (Ce2(HPO4)3) • Metafosforečnan ceritý (Ce(PO3)3) • Hydrogendifosforečnan ceritý (CeHP2O7) • Uhličitan ceritý (Ce2(CO3)3) • Wolframan ceritý (Ce2(WO4)3) • Vanadičnan ceritý (CeVO4) • Orthoboritan ceritý (CeBO3) |
| Soli tvořené záměnou vodíku ze sloučenin typu prvekx – vodíky | |