Hidrogen iodida
 | |
 | |
| Nama | |
|---|---|
| Nama IUPAC Iodana | |
| Nama lain Asam iodida (larutan berair) Iodin hidrida | |
| Penanda | |
Nomor CAS |
|
Model 3D (JSmol) |
|
| 3DMet | {{{3DMet}}} |
| ChEBI |
|
| ChemSpider |
|
| Nomor EC | |
| KEGG |
|
PubChem CID |
|
| Nomor RTECS | {{{value}}} |
| UNII |
|
| Nomor UN | 1787 2197 |
CompTox Dashboard (EPA) |
|
InChI
| |
SMILES
| |
| Sifat | |
Rumus kimia | HI |
| Massa molar | 127.904 g/mol |
| Penampilan | Gas tak berwarna |
| Densitas | 2.85 g/mL (-47 °C) |
| Titik lebur | −5.080 °C (−9.110 °F; −4.810 K) |
| Titik didih | −3.536 °C (−6.333 °F; −3.263 K) |
Kelarutan dalam air | kira-kira 245 g/100 ml |
| Keasaman (pKa) | -10 (dalam air, estimasi);[1] -9.5 (±1.0) [2] 2.8 (in acetonitrile)[3] |
| Asam konjugat | Iodonium |
| Basa konjugat | Iodida |
| Struktur | |
| Terminus | |
| 0.38 D | |
| Bahaya | |
| Bahaya utama | Toxic, corrosive, Harmful and Irritant |
| Lembar data keselamatan | hydrogen iodide hydroiodic acid |
| Piktogram GHS |  |
| Keterangan bahaya GHS | {{{value}}} |
| H314 | |
| P260, P264, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, P405, P501 | |
| Titik nyala | Non-flammable |
| Senyawa terkait | |
Anion lain | Hidrogen fluorida Hidrogen klorida Hidrogen bromida Hidrogen astatida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
 N verifikasi (apa ini N verifikasi (apa ini  Y Y N ?) N ?) | |
| Referensi | |
Hidrogen iodida (HI) adalah suatu molekul diatomik dan hidrogen halida. Larutan berair dari HI dikenal sebagai asam iodida, suatu asam kuat. Hidrogen iodida dan asam iodida adalah, namun, berbeda lantaran hidrogen iodida berbentuk gas dalam keadaan standar, sementara asam iodida adalah larutan berair dari gas tersebut. Keduanya saling dapat dikonversi. HI digunakan dalam sintesis organik dan anorganik sebagai salah satu sumber utama iodin serta sebagai agen pereduksi.
Sifat hidrogen iodida
HI adalah gas tidak berwarna yang bereaksi dengan oksigen menghasilkan air dan iodin. Dengan udara lembab, HI menghasilkan kabut (atau asap) asam iodida. Senyawa ini sangat larut dalam air, menghasilkan asam iodida. Satu liter air akan melarutkan 425 liter gas HI, larutan paling pekat yang hanya memiliki empat molekul air per molekul HI.[4]
Asam iodida
Asam iodida bukanlah hidrogen iodida murni, tetapi campuran yang mengandung hidrogen iodida. Asam iodida "konsentrat" komersial biasanya mengandung 48–57% HI menurut massanya. Larutannya membentuk azeotrop yang mendidih pada 127 °C dengan 57% HI, 43% air. Keasaman yang tinggi disebabkan oleh penyebaran muatan ionik pada anionnya. Jari-jari ion iodida jauh lebih besar daripada halida umum lainnya, yang mengakibatkan muatan negatif tersebar di ruang yang luas. Sebaliknya, ion klorida jauh lebih kecil, yang berarti muatan negatifnya lebih terkonsentrasi, menyebabkan interaksi yang lebih kuat antara proton dan ion klorida. Interaksi H+···I− yang lemah dalam HI memfasilitasi disosiasi proton dari anion dan karenanya HI merupakan asam yang sangat kuat dalam kelompok hidrohalida.
- HI(g) + H2O(l) → H3O+(aq) + I−(aq) Ka ≈ 1010
- HBr(g) + H2O(l) → H3O+(aq) + Br−(aq) Ka ≈ 109
- HCl(g) + H2O(l) → H3O+(aq) + Cl−(aq) Ka ≈ 106
Sintesis
Preparasi HI di industri melibatkan reaksi I2 dengan hidrazina, yang juga menghasilkan gas nitrogen:[5]
- 2 I2 + N2H4 → 4 HI + N2
Ketika dilakukan dalam air, HI harus didistilasi.
HI juga dapat didistilasi dari larutan NaI atau alkali iodida lainnya dalam asam fosfat pekat (perlu dicatat bahwa asam sulfat pekat tidak mampu mengasamkan iodida, karena akan mengoksidasi iodida menjadi unsur bebas iodinnya).
Cara lain HI dapat dibuat adalah dengan menggelegak uap hidrogen sulfida melalui larutan iodium berair, membentuk asam iodida (yang didistilasi) dan unsur belerang (zat ini disaring):[6]
- H2S + I2 → 2 HI + S
Selain itu, HI dapat disiapkan hanya dengan menggabungkan H2 dan I2:
- H2 + I2 → 2 HI
Metode ini biasanya digunakan untuk menghasilkan sampel dengan kemurnian tinggi.
Selama bertahun-tahun, reaksi ini dianggap melibatkan reaksi bimolekuler sederhana antara molekul-molekul H2 dan I2. Namun, ketika campuran gas disinari dengan panjang gelombang cahaya yang sama dengan energi disosiasi ikatan I2, sekitar 578 nm, laju reaksinya meningkat secara signifikan. Fakta ini mendukung mekanisme ketika I2 mula-mula terdisosiasi menjadi 2 atom iodin, masing-masing menempel pada sisi molekul H2 dan memecah ikatan H−H:[7]
Di laboratorium, metode lain melibatkan hidrolisis dari PI3, ekivalen iodin dari PBr3. Dalam metode ini, I2 bereaksi dengan fosfor menghasilkan fosfor triiodida, yang kemudian bereaksi dengan air menghasilkan HI dan asam fosfat:
- 3 I2 + 2 P + 6 H2O → 2 PI3 + 6 H2O → 6 HI + 2 H3PO3
Reaksi dan aplikasi penting
Larutan hidrogen iodida sangat mudah teroksidasi oleh udara:
- 4 HI + O2 → 2 H2O + 2 I2
- HI + I2 → HI3
HI3 berwarna coklat tua, yang membuat larutan HI lama sering tampak coklat tua.
Seperti HBr dan HCl, HI mengadisi alkena:[8]
- HI + H2C=CH2 → H3CCH2I
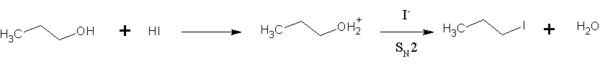
HI juga digunakan dalam reaksi organik untuk mengubah alkohol primer menjadi alkil halida.[9] Reaksi ini merupakan substitusi SN2, yang melibatkan penggantian ion iodida dengan gugus hidroksil (air) "teraktivasi".
HI lebih disukai daripada hidrogen halida lainnya karena ion iodida adalah nukleofil yang jauh lebih baik daripada bromida atau klorida, sehingga reaksi dapat berlangsung pada laju yang wajar tanpa banyak pemanasan. Reaksi ini juga terjadi untuk alkohol sekunder dan tersier, tetapi substitusi terjadi melalui jalur SN1.
HI (atau HBr) juga dapat digunakan untuk memecah eter menjadi alkil iodida dan alkohol, dalam reaksi yang mirip dengan substitusi alkohol. Jenis pembelahan ini penting karena dapat digunakan untuk mengubah senyawa kimia yang stabil[9] dan eter inert menjadi spesies yang lebih reaktif. Dalam contoh ini dietil eter dipecah menjadi etanol dan iodoetana:
Reaksi ini bersifat regioselektif, karena iodida cenderung menyerang karbon eter yang lebih sedikit terhambat secara sterik.
HI tunduk pada aturan Markovnikov dan anti-Markovnikov yang sama seperti HCl dan HBr.
Meskipun keras menurut standar modern, HI umumnya digunakan sebagai zat pereduksi di awal sejarah kimia organik. Ahli kimia pada abad ke-19 berusaha untuk menyiapkan sikloheksana dengan reduksi HI dari benzena pada suhu tinggi, tetapi malah mengisolasi produk yang disusun ulang, methylcyclopentane (lihat artikel tentang sikloheksana). Seperti yang pertama kali dilaporkan oleh Kiliani,[10] reduksi asam iodida dari gula dan poliol lainnya menghasilkan pembelahan reduktif dari beberapa atau bahkan semua gugus hidroksi, meskipun seringkali dengan hasil dan/atau reproduktifitas yang buruk.[11] Dalam kasus benzil alkohol dan alkohol dengan gugus -karbonil, reduksi oleh HI dapat memberikan hasil sintetis yang berguna dari produk hidrokarbon yang sesuai (ROH + 2HI → RH + H2O + I2).[8] Proses ini dapat dibuat katalitik di HI menggunakan fosfor merah untuk mereduksi I2 yang terbentuk.[12]
Referensi
- Catatan kaki
- ^ Bell, R.P. The Proton in Chemistry. 2nd ed., Cornell University Press, Ithaca, NY, 1973.
- ^ Trummal, A.; Lipping, L.; Kaljurand, I.; Koppel, I. A.; Leito, I. "Acidity of Strong Acids in Water and Dimethyl Sulfoxide" J. Phys. Chem. A. 2016, 120, 3663-3669. DOI:10.1021/acs.jpca.6b02253
- ^ Raamat, E.; Kaupmees, K.; Ovsjannikov, G.; Trummal, A.; Kütt, A.; Saame, J.; Koppel, I.; Kaljurand, I.; Lipping, L.; Rodima, T.; Pihl, V.; Koppel, I. A.; Leito, I. "Acidities of strong neutral Brønsted acids in different media." J. Phys. Org. Chem. 2013, 26, 162-170. DOI:10.1002/poc.2946
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Greenwood, N. N. and A. Earnshaw. The Chemistry of the Elements. Edisi ke-2. Oxford: Butterworth-Heineman. hlm. 809–815. 1997.
- ^ Joseph Louis Gay-Lussac (1815), "A Memoir on Iodine", Annals of Philosophy, 5: 101
- ^ Holleman, A. F. Wiberg, E. Inorganic Chemistry. San Diego: Academic Press. hlm. 371, 432–433. 2001.
- ^ a b Breton, G. W., P. J. Kropp, P. J.; Harvey, R. G. "Hydrogen Iodide" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289X.
- ^ a b Bruice, Paula Yurkanis. Organic Chemistry Edisi ke-4. Prentice Hall: Upper Saddle River, N. J, 2003 hlm. 438–439, 452.
- ^ Kiliani, Heinrich (1886-01-01). "Ueber die Constitution der Dextrosecarbonsäure". Berichte der Deutschen Chemischen Gesellschaft (dalam bahasa Inggris). 19 (1): 1128–1130. doi:10.1002/cber.188601901251. ISSN 1099-0682.
- ^ Perlin, A. S.; Purves, C. B. (1953-03-01). "Kiliani's Reduction of Glucose and Fructose Cyanohydrins to the Corresponding Heptanoic Acids and Lactones". Canadian Journal of Chemistry. 31 (3): 227–236. doi:10.1139/v53-033
 . ISSN 0008-4042.
. ISSN 0008-4042. - ^ Dobmeier, Michael; Herrmann, Josef M; Lenoir, Dieter; König, Burkhard (2012-03-02). "Reduction of benzylic alcohols and α-hydroxycarbonyl compounds by hydriodic acid in a biphasic reaction medium". Beilstein Journal of Organic Chemistry (dalam bahasa Inggris). 8 (1): 330–336. doi:10.3762/bjoc.8.36. PMC 3302097
 . PMID 22423302.
. PMID 22423302.
- Bacaan lebih lanjut
- Nishikata, E., T.; Ishii, and T. Ohta. "Viscosities of Aqueous Hydrochloric Acid Solutions, and Densities and Viscosities of Aqueous Hydroiodic Acid Solutions". J. Chem. Eng. Data. 26. 254-256. 1981.
Pranala luar
- International Chemical Safety Card 1326
![{\displaystyle {\ce {{H2}+{I2}->[{\text{radiasi 578 nm}}]{H2}+2I->I{\cdots }H{\cdots }H{\cdots }I->2HI}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf039a928c8dc6e6cc4e911f4716742cb3346c50)