Samarium(III) klorida
 | |
 | |
| Nama | |
|---|---|
| Nama IUPAC Samarium(III) klorida | |
| Nama lain Samarium triklorida Triklorosamarium | |
| Penanda | |
Nomor CAS |
|
Model 3D (JSmol) |
|
| 3DMet | {{{3DMet}}} |
| ChemSpider |
|
| Nomor EC | |
PubChem CID |
|
| Nomor RTECS | {{{value}}} |
| UNII |
|
CompTox Dashboard (EPA) |
|
InChI
| |
SMILES
| |
| Sifat | |
Rumus kimia | SmCl3 |
| Massa molar | 256,76 g/mol (anhidrat) 364,80 g/mol (heksahidrat) |
| Penampilan | Padatan kuning pucat (anhidrat) Padatan krem (heksahidrat) |
| Densitas | 4,46 g/cm3 (anhidrat) 2,383 g/cm3 (heksahidrat) |
| Titik lebur | 682 °C (1.260 °F; 955 K) |
| Titik didih | terurai |
Kelarutan dalam air | 92,4 g/100 mL (10 °C) |
| Struktur | |
Struktur kristal | Heksagonal, hP8 |
| P63/m, No. 176 | |
| Prisma trigonal bertudung-tiga (9 koordinat) | |
| Bahaya | |
| Bahaya utama | Iritan |
| Piktogram GHS |  |
| Keterangan bahaya GHS | {{{value}}} |
| H315, H319 | |
| P264, P280, P302+352, P305+351+338, P321, P332+313, P337+313, P362 | |
| Senyawa terkait | |
Anion lain | Samarium(III) fluorida Samarium(III) bromida Samarium(III) iodida |
Kation lainnya | Samarium(II) klorida Prometium(III) klorida Europium(III) klorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
 N verifikasi (apa ini N verifikasi (apa ini  Y Y N ?) N ?) | |
| Referensi | |
Samarium(III) klorida, juga dikenal sebagai samarium triklorida, adalah sebuah senyawa anorganik dari samarium dan klorin. Senyawa ini merupakan garam berwarna kuning pucat yang dengan cepat menyerap air untuk membentuk heksahidrat, SmCl3.6H2O.[1] Senyawa ini memiliki beberapa aplikasi praktis tetapi digunakan di laboratorium untuk penelitian mengenai senyawa samarium baru.
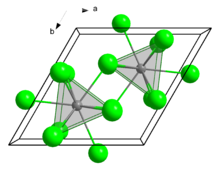
Struktur
Seperti beberapa senyawa klorida lantanida dan aktinida terkait lainnya, SmCl3 mengkristal dalam motif UCl3. Pusat Sm3+ memiliki sembilan koordinat, menempati situs prisma trigonal dengan ligan klorida tambahan yang menempati tiga permukaan persegi.
Pembuatan dan reaksi
SmCl3 dibuat melalui rute "amonium klorida", yang melibatkan sintesis awal (NH4)2[SmCl5]. Bahan ini dapat dibuat dari bahan awal yang umum pada suhu reaksi 230 °C dari samarium oksida:[2]
- 10 NH4Cl + Sm2O3 → 2 (NH4)2[SmCl5] + 6 NH3 + 3 H2O
Bentuk pentaklorida kemudian dipanaskan hingga suhu 350-400 °C yang menghasilkan evolusi amonium klorida dan meninggalkan residu samarium triklorida anhidrat:
- (NH4)2[SmCl5] → 2 NH4Cl + SmCl3
Senyawa ini juga dapat dibuat dari logam samarium dan asam klorida.[3][4]
- 2 Sm + 6 HCl → 2 SmCl3 + 3 H2
Larutan samarium(III) klorida berair dapat dibuat dengan melarutkan logam samarium atau samarium karbonat dalam asam klorida.
Samarium(III) klorida adalah asam Lewis yang cukup kuat, yang digolongkan sebagai "asam keras" menurut konsep HSAB. Larutan samarium(III) klorida berair dapat digunakan untuk membuat samarium(III) fluorida:
- SmCl3 + 3 KF → SmF3 + 3 KCl
Kegunaan
Samarium(III) klorida digunakan untuk pembuatan logam samarium, yang memiliki berbagai kegunaan, terutama dalam magnet. SmCl3 anhidrat dicampur dengan natrium klorida atau kalsium klorida untuk menghasilkan campuran eutektik dengan titik lebur yang rendah. Elektrolisis larutan garam cair ini akan menghasilkan logam samarium bebas.[5]
Dalam laboratorium
Samarium(III) klorida juga dapat digunakan sebagai titik awal untuk pembuatan garam samarium lainnya. SmCl3 anhidrat digunakan untuk membuat senyawa organologam samarium, seperti kompleks bis(pentametilsiklopentadienil)alkilsamarium(III).[6]
Referensi
- ^ F. T. Edelmann, P. Poremba (1997). W. A. Herrmann, ed. Synthetic Methods of Organometallic and Inorganic Chemistry. 6. Stuttgart: Georg Thieme Verlag.
- ^ Meyer, G. (1989). "The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides—The Example of Ycl 3". The Ammonium Chloride Route to Anhydrous Rare Earth Chlorides-The Example of YCl3. Inorganic Syntheses. 25. hlm. 146–150. doi:10.1002/9780470132562.ch35. ISBN 978-0-470-13256-2.
- ^ L. F. Druding, J. D. Corbett (1961). "Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide". J. Am. Chem. Soc. 83 (11): 2462–2467. doi:10.1021/ja01472a010.
- ^ J. D. Corbett (1973). "Reduced Halides of the Rare Earth Elements". Rev. Chim. Minérale. 10: 239.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 0-08-022057-6.
- ^ G. A. Molander, E. D. Dowdy (1999). Shu Kobayashi, ed. Lanthanides: Chemistry and Use in Organic Synthesis. Berlin: Springer-Verlag. hlm. 119–154. ISBN 3-540-64526-8.
- l
- b
- s
| HCl | He | ||||||||||||||||
| LiCl | BeCl2 | BCl3 B2Cl4 | CCl4 | NCl3 ClN3 | Cl2O ClO2 Cl2O7 | ClF ClF3 ClF5 | Ne | ||||||||||
| NaCl | MgCl2 | AlCl AlCl3 | SiCl4 | P2Cl4 PCl3 PCl5 | S2Cl2 SCl2 SCl4 | Cl2 | Ar | ||||||||||
| KCl | CaCl CaCl2 | ScCl3 | TiCl2 TiCl3 TiCl4 | VCl2 VCl3 VCl4 VCl5 | CrCl2 CrCl3 CrCl4 | MnCl2 | FeCl2 FeCl3 | CoCl2 CoCl3 | NiCl2 | CuCl CuCl2 | ZnCl2 | GaCl2 GaCl3 | GeCl2 GeCl4 | AsCl3 AsCl5 | Se2Cl2 SeCl4 | BrCl | KrCl |
| RbCl | SrCl2 | YCl3 | ZrCl3 ZrCl4 | NbCl4 NbCl5 | MoCl2 MoCl3 MoCl4 MoCl5 MoCl6 | TcCl4 | RuCl3 | RhCl3 | PdCl2 | AgCl | CdCl2 | InCl InCl2 InCl3 | SnCl2 SnCl4 | SbCl3 SbCl5 | Te3Cl2 TeCl4 | ICl ICl3 | XeCl XeCl2 |
| CsCl | BaCl2 | HfCl4 | TaCl5 | WCl2 WCl3 WCl4 WCl5 WCl6 | Re3Cl9 ReCl4 ReCl5 ReCl6 | OsCl4 | IrCl2 IrCl3 IrCl4 | PtCl2 PtCl4 | AuCl AuCl3 | Hg2Cl2, HgCl2 | TlCl | PbCl2, PbCl4 | BiCl3 | PoCl2, PoCl4 | AtCl | RnCl2 | |
| FrCl | RaCl2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| LaCl3 | CeCl3 | PrCl3 | NdCl2, NdCl3 | PmCl3 | SmCl2, SmCl3 | EuCl2, EuCl3 | GdCl3 | TbCl3 | DyCl2, DyCl3 | HoCl3 | ErCl3 | TmCl2 TmCl3 | YbCl2 YbCl3 | LuCl3 | |||
| AcCl3 | ThCl4 | PaCl5 | UCl3 UCl4 UCl5 UCl6 | NpCl4 | PuCl3 | AmCl2 AmCl3 | CmCl3 | BkCl3 | CfCl3 | EsCl3 | Fm | Md | No | LrCl3 | |||









