Acido cloroso

| Acido cloroso | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido diossoclorico (III) | |
| Nomi alternativi | |
| acido cloroso | |
| Caratteristiche generali | |
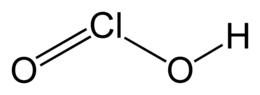
| Formula bruta o molecolare | HClO2 |
| Peso formula (u) | 68.46 |
| Aspetto | liquido incolore |
| Numero CAS | 13898-47-0 |
| PubChem | 24453 |
| SMILES | OCl=O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 298 K | 1,1×10−2 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 | |
| Modifica dati su Wikidata · Manuale | |
L'acido cloroso è un ossiacido del cloro trivalente, Cl(III), avente formula HClO2. Non è noto allo stato puro ma, come accade anche per HClO3 e HClO, solo nelle sue soluzioni acquose, dove si comporta da acido debole. Ha forti proprietà ossidanti, che condivide con i suoi sali, i cloriti. Questi ultimi sono utilizzati nella produzione industriale del diossido di cloro.
Tende a dismutare secondo la seguente reazione, e questo lo rende un prodotto non disponibile commercialmente:
Sintesi
L'acido cloroso può essere sintetizzato dalla reazione tra il clorito di bario e acido solforico diluito:
Applicazioni
I sali di questo acido vengono sintetizzati dal diossido di cloro, e non direttamente dall'acido. La sua pericolosità nello stoccaggio e la facilità di decomposizione fa sì che l'acido cloroso non abbia applicazioni al di fuori del laboratorio.
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su acido cloroso
Wikimedia Commons contiene immagini o altri file su acido cloroso
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia













