尿素
| 尿素 | |
|---|---|
 | |
 |  |
 | |
別称 Carbamide, carbonyl diamide, carbonyldiamine, diaminomethanal, diaminomethanone | |
| 識別情報 | |
| CAS登録番号 | 57-13-6  |
| PubChem | 1176 |
| ChemSpider | 1143  |
| UNII | 8W8T17847W  |
| E番号 | E927b (その他) |
| DrugBank | DB03904 |
| KEGG | D00023  |
| ChEBI |
|
| ChEMBL | CHEMBL985  |
| RTECS番号 | YR6250000 |
| ATC分類 | B05BC02,D02AE01 (WHO) |
| |
| |
| 特性 | |
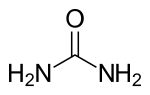
| 化学式 | CH4N2O |
| モル質量 | 60.06 g mol−1 |
| 示性式 | CO(NH2)2 |
| 外観 | 白色の固体 |
| 密度 | 1.32 g/cm3 |
| 融点 | 133–135 °C |
| 水への溶解度 | 107.9 g/100 ml (20 °C) 167 g/100ml (40 °C) 251 g/100 ml (60 °C) 400 g/100 ml (80 °C) |
| 溶解度 | 50g/L エタノール, 500g/L グリセロール[1] |
| 塩基解離定数 pKb | 13.82[2] |
| 構造 | |
| 双極子モーメント | 4.56 D |
| 危険性 | |
| 安全データシート(外部リンク) | JT Baker |
| 半数致死量 LD50 | 8500 mg/kg (oral, rat) |
| 関連する物質 | |
| 関連する | チオ尿素 ヒドロキシカルバミド |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
尿素(にょうそ、英: urea)は、有機化合物で、生体の代謝に使われ尿中に排泄される。カルバミドともいう。無機化合物から初めて合成された有機化合物として、有機化学史上、重要な物質である。
保水作用があり皮膚に水分を保持している成分のひとつで[3]、保湿剤や濃度を高くし角質融解に使われる[4]。肥料や防氷剤にも使われる。
性質
無色無臭の結晶で、哺乳類や両生類の尿に多く含まれる。水に容易に溶け、その溶解度は 108 g/100 mL (20 ℃)。潮解性を持つ。非線形光学現象を示す。加熱すると分解し、アンモニア、ビウレット、シアヌル酸に変わる。
尿素の結晶の構造には、小分子が入るのにちょうど良い大きさの空孔がある。そのため尿素は、ヘキサンなど、さまざまな化合物と安定な包接化合物を作る。過酸化水素との包接化合物(尿素-過酸化水素付加体、略称 UHP)は、固体の形で取り扱える酸化剤として市販されている。
製法
工業的にはアンモニアと二酸化炭素を原料として120℃、150気圧以上で合成する[5]、あるいは液体アンモニアと固体二酸化炭素(ドライアイス)を混合して得られる。 反応機構はカルバミン酸アンモニウムを経由する。
また、硫化カルボニルとアンモニアを60~100 ℃で反応させても得られる[6]。
ホスゲンとアンモニア(尿素誘導体の合成ではアミン)との反応でも得られる。
窒素の排泄
最も簡単な窒素化合物はアンモニアであるが、生体に有害なため、安全な尿素として貯めた後に水溶液として排泄される。ただし水溶性であるから水と共に捨てなければならず、濃縮にも一定のエネルギーを要する。水の確保が重要な問題となる生活ではこの点で非水溶性の尿酸にしたほうが有利となる。爬虫類や鳥類の糞に含まれる白い部分は、非水溶性の固体の尿である尿酸である。
窒素の排泄は、硬骨魚類では主にアンモニア、哺乳類、両生類、軟骨魚類では主に尿素、鳥類や爬虫類の多くでは主に尿酸のかたちで行われる[7][8]。なお、軟骨魚類は、浸透圧調節のため、尿素やトリメチルアミンオキサイドをオスモライトとして体内に蓄積している[9]。
ヒトにおいてもタンパク質などに取り入れた窒素のうち、過剰分やアンモニアが尿素回路を通って尿素の形になり尿中に排泄される(成人は尿素を 1日 30 g ほど排泄する)。一方、プリンヌクレオチドは尿酸まで代謝されたところで、体内ではビタミンCに代わる抗酸化物質として利用され、尿酸を分解する酵素活性が失われているため、アラントインや尿素に分解する経路を持たず、尿酸の一部が活性酸素やストレスなどへの抗酸化作用によって代謝されてゆく。このため過剰なストレスで尿酸の生産が亢進され、尿酸の排泄が追いつかなくなり結晶化して有害性を示すことがある(痛風)。
用途
日用品として
尿素の用途として、保湿クリーム・肥料などとして広く使われており、ホルムアルデヒド (HCHO) と反応させることで尿素樹脂(ユリア樹脂)も得ることが出来る。高濃度の水溶液はタンパク質、核酸を変性させる作用がある。
皮膚の角質細胞内で塩化して、水分を保持している成分のひとつ[3]。尿素は10%まで皮膚の保湿剤として、それ以上で皮膚の角質融解作用を示す[4]。抗真菌薬や抗炎症薬の浸透促進剤として働く。
窒素を多く含み、植物の葉や茎を育てる化成肥料として、農業でも使用される。(ただし、尿素は微生物による分解・化学変化を経てからアンモニア、硝酸の形での吸収・利用が行われるので、肥料の効果が出るのに多少の時間を必要とする。)
水と混ぜると吸熱効果が現れる。硝酸アンモニウムと尿素の混合物を水の入った袋と同封し、衝撃を加えて混合物を反応させ冷却効果を得る携帯用の瞬間冷却剤としての用途もある。
またディーゼルエンジンでは、尿素を水に溶かした尿素水(AdBlue)を使って窒素酸化物を分解している(尿素SCRシステム)[1]。具体的には、尿素をディーゼルエンジンの排熱で分解し、放出されるアンモニアと排気中に含まれる窒素酸化物を化学反応させ、水と窒素に還元させる。
航空機の機体や滑走路に散布する凍結防止剤として、尿素を主成分とした防氷剤として使用される。一般的に使用される塩化カルシウムと異なり、金属への腐食性が無いため、微細な腐食から重大事故へつながる可能性が排除できない航空機に散布される。
ヘリコバクター・ピロリの感染検査(迅速ウレアーゼ試験、尿素呼気試験)に使用される。
-
 叩くと温度が下がる瞬間冷却剤
叩くと温度が下がる瞬間冷却剤 -
 フランスのAdBlueスタンド
フランスのAdBlueスタンド
分析化学における用途
尿素は均一沈殿法において、アンモニアまたはアンモニウムイオンの供給に用いられる。下に示すのは加熱下における尿素の加水分解である[10]。
pHの調整を伴う沈殿形成時に気体アンモニアの代用となる[11][12]。
また、シュウ酸とは尿素シュウ酸塩の沈殿を形成する。これはシュウ酸または尿素の検出に用いられる[13]。
歴史

尿素は、人間の手によって初めて無機化合物のみから合成された有機化合物として、有機化学の歴史上非常に重要な化合物である。 フリードリヒ・ヴェーラーは1828年にその合成に成功した。彼は、シアン酸アンモニウムの水溶液を加熱して尿素が生成することを確認した。この合成法はヴェーラー合成と呼ばれている。
その当時の化学では、有機化合物は生物にしか作り出すことができないという考え(生気論)が正当とされてきたが、ヴェーラーの実験結果はそれをくつがえすもののひとつとなった(ただし、尿素は炭酸のアミドに相当し、炭酸は通常有機化合物に含まれない。このため尿素を真に有機化合物と呼んでよいかは議論がある)。
脚注
- ^ http://toxnet.nlm.nih.gov/cgi-bin/sis/search/f?./temp/~ZAvqWP:1:sol [リンク切れ]
- ^ “pKa Data” (2001年10月24日). 2010年6月2日時点のオリジナルよりアーカイブ。2009年11月27日閲覧。
- ^ a b Purnamawati S, Indrastuti N, Danarti R, Saefudin T (December 2017). “The Role of Moisturizers in Addressing Various Kinds of Dermatitis: A Review”. Clin Med Res (3-4): 75–87. doi:10.3121/cmr.2017.1363. PMC 5849435. PMID 29229630. http://www.clinmedres.org/content/15/3-4/75.full.
- ^ a b Celleno L (November 2018). “Topical urea in skincare: A review”. Dermatol Ther (6): e12690. doi:10.1111/dth.12690. PMID 30378232.
- ^ “尿素合成”. 独立行政法人 石油天然ガス・金属鉱物資源機構. 2010年9月閲覧。
- ^ 井上 繁. “尿素合成プロセス”. 2024年3月22日閲覧。
- ^ にょうそ【尿素】の意味 - 国語辞書 goo辞書
- ^ 有馬四郎「兩棲類の發生初期の代謝終産物について : I.蛙尿の化學成分について」 動物学雑誌 61(9), 1952-09-15, pp275-277 NAID 110003360889
- ^ 石橋賢一「大学院特論講義:水電解質研究の進歩」『明治薬科大学研究紀要 』38号、2009年05月31日、pp21-28 尿素 - J-GLOBAL
- ^ 古畑 朋彦,関 直人,新井 雅隆. “高温雰囲気中における尿素の熱分解挙動”. 2024年3月22日閲覧。
- ^ 滝山 一善, Louis Gordon. “均一溶液からの沈殿生成に関する最近の進歩”. 2024年3月22日閲覧。
- ^ 松田 恵三・堀田 健治・藤田 一美・光沢 舜明. “尿素の加水分解を用い る均一沈殿法による リン酸 マ グネ シウム五水和 物の合成”. 2024年3月22日閲覧。
- ^ A Demonstration of Wöhler's Experiment: Preparation of Urea from Ammonium Chloride and Potassium Cyanate Zoltán Tóth. J. Chem. Educ. 73 539.. (1996).
| |
|---|---|
|
- 表示
- 編集


















