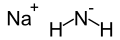Amidek sodu
| |||||||||||||||||||||||||
 Struktura krystaliczna | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny | NaNH | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 39,01 g/mol | ||||||||||||||||||||||||
| Wygląd | biały krystaliczny proszek[1] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | 7782-92-5 | ||||||||||||||||||||||||
| PubChem | 24533 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Amidek sodu, NaNH
2 – nieorganiczny związek chemiczny z grupy amidków, sól sodu i amoniaku (który pełni w tym przypadku rolę kwasu).
Otrzymywanie
Otrzymać go można w wyniku przepuszczania amoniaku nad metalicznym sodem w temp. 350–360 °C[4] (w warunkach przemysłowych 350–400 °C[5]):
- 2Na + 2NH
3 → 2NaNH
2 + H
2
Wymagana jest sucha atmosfera beztlenowa[5].
Natomiast reakcja sodu z ciekłym amoniakiem prowadzi do wytworzenia kationów sodowych i tzw. solwatowanych elektronów o intensywnym, głębokoniebieskim kolorze[5][6]:
- Na + xNH
3 → Na+
+ e−
·xNH
3
Właściwości fizyczne
Rozpuszcza się w ciekłym amoniaku, lecz jedynie w niewielkim stopniu (0,14g /100g NH
3 w 0 °C); z roztworu takiego można go uzyskać w postaci krystalicznej, przy czym nie tworzą się amoniakaty[a][5].
Właściwości chemiczne
Reaguje gwałtownie z wodą z wydzieleniem wodorotlenku sodu i amoniaku[5][6]:
- NaNH
2 + H
2O → NaOH + NH
3↑
Jest silną zasadą. Jako medium do reakcji z jego udziałem stosuje się ciekły amoniak lub węglowodory. Jego reakcja z solami amonowymi ma taki sam charakter, jak neutralizacja standardowych kwasów i zasad w środowisku wodnym, np. [5]:
- NaNH
2 + NH
4Cl → NaCl + 2NH
3
Jego zasadowość jest na tyle duża, że jest zdolny do odrywania kwasowych atomów wodoru niektórych węglowodorów, np. acetylenu lub di- i trifenylometanu, i tworzenia z nimi soli sodowych[5].
Stosowany jest do otrzymywania alkinów z dichloroalkanów, syntezy amin aromatycznych, inicjowania polimeryzacji anionowej oraz w reakcji Cziczibabina[5].
Uwagi
Przypisy
- ↑ a b c Sodium amide, [w:] PubChem, United States National Library of Medicine, CID: 24533 (ang.).
- ↑ a b c d CRC Handbook of Chemistry and Physics, William M.W.M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-85, ISBN 978-1-4987-5429-3 (ang.).
- ↑ Amidek sodu, karta charakterystyki produktu Sigma-Aldrich, Merck, 1 lipca 2021, numer katalogowy: 432504 [dostęp 2021-10-31] . (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ F.W.F.W. Bergstrom F.W.F.W., Sodium amide, „Organic Syntheses”, 20, 1940, s. 84, DOI: 10.15227/orgsyn.020.0086 .
- ↑ a b c d e f g h LudwigL. Lange LudwigL., WolfgangW. Triebel WolfgangW., Sodium amide, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, DOI: 10.1002/14356007.a24_267, ISBN 978-3-527-30673-2 (ang.).
- ↑ a b AdamA. Bielański AdamA., Podstawy chemii nieorganicznej, wyd. 5, Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 652–653, ISBN 83-01-13654-5 .