Pentatlenek diazotu
| |||||||||||||||||||||||
 struktura N 2O 5 w formie kowalencyjnej | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny | N2O5 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 108,01 g/mol | ||||||||||||||||||||||
| Wygląd | bezbarwne kryształy[2] | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | 10102-03-1 | ||||||||||||||||||||||
| PubChem | 66242 | ||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Podobne związki | N | ||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
| |||||||||||||||||||||||
Pentatlenek diazotu (nazwa Stocka: tlenek azotu(V)), N
2O
5 – nieorganiczny związek chemiczny z grupy tlenków azotu, w którym każdy atom azotu występuje na formalnym stopniu utlenienia V.
Budowa
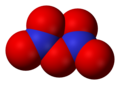
W zależności od warunków, pentatlenek diazotu może występować w dwóch formach, kowalencyjnej i jonowej:
- N
2O
5 ⇌ [NO
2]+
[NO
3]−
W stanie gazowym i w rozpuszczalnikach niepolarnych (np. w CCl
4) N
2O
5 ma prawdopodobnie budowę kowalencyjną z mostkiem tlenowym łączącym atomy azotu (N−O−N). Badania rentgenograficzne dowiodły, że w stanie stałym ma on strukturę jonową – [NO
2]+
[NO
3]−
– jest więc solą, azotanem nitroniowym. Szybkie schłodzenie gazowego N
2O
5 pozwala na uzyskanie metastabilnej kowalencyjnej formy związku w stanie stałym, która w temperaturze powyżej −70 °C przechodzi egzotermicznie w formę jonową[5].
Otrzymywanie
W warunkach laboratoryjnych otrzymuje się go przez ostrożne odwodnienie kwasu azotowego pentatlenkiem difosforu[3]:
- 2HNO
3 + P
2O
5 → 2HPO
3 + N
2O
5
Inne metody syntezy to utlenianie dwutlenku azotu lub innych niższych tlenków azotu ozonem oraz reakcje azotanu srebra z chlorem lub trichlorkiem fosforylu (POCl) na gorąco, np.
- 2AgNO
3 + Cl
2 → AgCl + 2NO
2Cl + O
2 - AgNO
3 + NO
2Cl → AgCl + N
2O
5
Właściwości
Pentatlenek diazotu w temperaturze pokojowej występuje w formie białych kryształków. Jest związkiem nietrwałym rozkładającym się spontanicznie w temperaturze pokojowej do dwutlenku azotu i tlenu. Z mocnymi kwasami daje sole nitroniowe i kwas azotowy, np.
- HClO
4 + N
2O
5 → NO
2ClO
4 + HNO
3
Związek ten reaguje gwałtownie z wodą, jest bezwodnikiem kwasu azotowego. Ze względu na jego nietrwałość nie znajduje on w formie czystej praktycznych zastosowań.
Przypisy
- ↑ a b c Neil G.N.G. Connelly Neil G.N.G. i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 318, ISBN 978-0-85404-438-2 (ang.).
- ↑ a b c d e CRC Handbook of Chemistry and Physics, William M.W.M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-76, ISBN 978-1-4987-5429-3 (ang.).
- ↑ a b AdamA. Bielański AdamA., Podstawy chemii nieorganicznej, t. 2, Warszawa: Państwowe Wydawnictwo Naukowe, 1994, s. 662, ISBN 83-01-06542-7 .
- ↑ George L.G.L. Lewis George L.G.L., Charles P.Ch.P. Smyth Charles P.Ch.P., The Dipole Moments and Structures of Certain Nitro Compounds and Amines, „Journal of the American Chemical Society”, 61 (11), 1939, s. 3067–3070, DOI: 10.1021/ja01266a027 (ang.).
- ↑ A.F.A.F. Holleman A.F.A.F., E.E. Wiberg E.E., Inorganic Chemistry, San Diego: Academic Press, 2001, ISBN 0-12-352651-5 .
Bibliografia
- LinusL. Pauling LinusL., PeterP. Pauling PeterP., Chemia, Warszawa: Wydawnictwo Naukowe PWN, 1998, s. 229, ISBN 83-01-12267-6 .
- Philip JohnP.J. Durrant Philip JohnP.J., BrylB. Durrant BrylB., Zarys współczesnej chemii nieorganicznej, Warszawa: Państwowe Wydawnictwo Naukowe, 1965 .
- Britannica: science/dinitrogen-pentoxide