Ernest Rutherford
| Ernest Rutherford | |
 | |
| Rođenje | (1871-08-30)30. 8. 1871. Brightwater, Novi Zeland |
|---|---|
| Smrt | 19. 10. 1937. (dob: 66) Cambridge, Engleska |
| Prebivalište | Novi Zeland, UK, Kanada |
| Državljanstvo | Ujedinjeno Kraljevstvo |
| Etnicitet | Britanac |
| Institucija | McGill University University of Manchester |
| Alma mater | University of Canterbury Cambridge University |
| Istaknuti studenti | Alexander MacAulay Ernest Walton Robert William Boyle Cecil Powell Nazir Ahmed |
| Poznat po | Otac nuklearne fizike Rutherfordov model Rutherfordovo raspršivanje Rutherfordova spektroskopija raspršivanja otkriće protona Rutherford (jedinica) skovao izraz 'umjetna dezintegracija' |
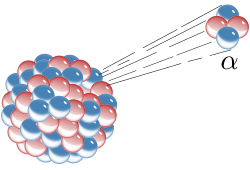

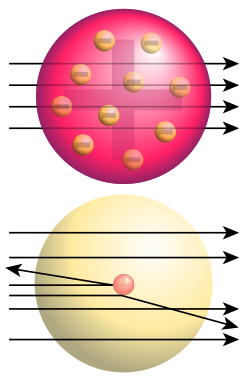
Donja slika: Dobiveni rezultati: samo mali dio alfa-čestice skreće, pokazujući da postoji pozitivan naboj u atomskoj jezgri (treba napomenuti da mjere nisu stvarne, atomska jezgra je još puno manja). To je Rutherfordov model atoma.

Ernest Rutherford (Nelson, Novi Zeland, 30. kolovoza 1871. - Cambridge, 19. listopada 1937.), britanski kemičar i fizičar.
Bio je profesor na fakultetu u Montrealu; pročelnik odjela za fiziku Sveučilišta u Manchesteru (od 1907.), a od 1919. direktor Cavendisheva laboratorija u Cambridgeu. Godine 1903. izabran za člana (1925.-1930. za predsjednika) Kraljevskog društva. Nobelovu nagradu za kemiju dobio 1908. godine. Isprva se bavio proučavanjem radioaktivnih raspada. Prvi je uočio da se zračenje radija sastoji od dviju vrsta zraka, koje je nazvao alfa-zrake (α čestica) i beta-zrake (β čestica) te gama-zračenje (γ čestica). Zajedno sa Frederickom Soddyem uveo je pojam vremena poluraspada i formulirao zakone radioaktivnog raspada. Proučavanjem raspršivanja alfa-čestica na atomima Rutherford je došao do zaključka da atom čija je veličina 10-8 cm nije kompaktan djelić materije, nego složen od pozitivne jezgre (veličine 10-12 cm) i elektrona koji kruže oko nje. Rutherford je prvi upotrijebio riječ proton za pozitivno naelektriziranu česticu u jezgri atoma.
Od njega potječe i formula (nazvana njegovim imenom) za raspršivanje alfa-čestica na atomima; kasnije (1925. godine), Rutherford je utvrdio i odstupanje od te formule do kojeg dolazi kod vrlo bliskih sudara alfa-čestice i jezgre, kad nuklearno međudjelovanje postaje mnogo važnije od električnog. [1]
Godine 1919. Rutherford je, bombardirajući dušik alfa-česticama izveo prvu pretvorbu (transmutaciju) jednog elementa u drugi. Pri procesu je nastao kisik, tako je izvršena prva nuklearna reakcija.
Životopis
Rutherfordovi roditelji su bili farmeri, koji su emigrirali iz Škotske na Novi Zeland, da bi lakše podigli puno djece, koje su imali. Ernest je završio elektrotehničku školu, a kasnije je putovao u Veliku Britaniju, da bi se usavršio u mjerenju i otkrivanju elektromagnetskih valova. Bio je profesor na Univerzitetu Montréal; pročelnik odjela za fiziku Sveučilišta u Manchesteru (od 1907.), a od 1919. direktor Cavendisheva laboratorija u Cambridgeu. 1900. se oženio i imao je jednu kćer. [2]
Znanstvena istraživanja
Početkom 20. stoljeća bilo je poznato 5 radioaktivnih elemenata: uranij, torij, polonij, aktinij i radij. Među njima najviše se upotrebljavao radij i to za liječenje raka. Iz radija i njegovih kemijskih spojeva stalno se razvijao jedan plin, koji je isto bio radioaktivan, a nazvan je radijeva emanacija ili radon. Osim radona nastajao je i helij. Iz toga se zaključilo da se radij, ali i svi ostali radioaktivni elementi, pretvaraju u druge elemente s manjom težinom i pri tom postupku zrače. Uočeno je također da je ta prirodna radioaktivnost svojstvena atomima s najvećim atomskim masama i da je to proces koji se dešava u unutrašnjosti atoma, znači ne ovisi o vanjskim utjecajima, kao što su tlak, temperatura ili neka kemijska reakcija.
Radioaktivno zračenje
Već 1900. bilo je poznato da jedan dio radioaktivnog zračenja može da skreće u magnetskom polju. Rutherford je na osnovu ispitivanja prolaza radioaktivnih zraka kroz tanke listiće aluminija utvrdio da kod zračenja uranijevih spojeva postoje dvije vrste zraka. Onu vrstu zraka koje ne mogu da prođu kroz aluminijsku pločicu debljine 0,02 mm nazvao je alfa-česticama, a onu vrstu koja je prolazila i kroz deblje slojeve nazvao je beta-česticama. Iste godine francuski znanstvenik Paul Villard je otkrio i treću vrstu radioaktivnog zračenja, za koju se utvrdilo da ima veliku prodornu moć i da ne skreće u magnetskom polju, a nazvane su gama-česticama. Na osnovu skretanja u magnetskom polju, utvrdeno je da alfa-čestice imaju pozitivni električni naboj, a beta-čestice negativan električni naboj.
1908. su Rutherford i Hans Geiger mjerenjem utvrdili da alfa-čestice imaju dvostruki električni naboj, a da im je masa jednaka četverostrukoj masi atoma vodika. Kada alfa-čestica privuče dva elektrona, ona prelazi u atom helija. Iz toga je Rutherford zaključio da su alfa-čestice ustvari ioni helija ili samo atomska jezgra helija. Za beta-čestice se utvrdilo da se u magnetnom i električnom polju ponašaju isto kao i katodne zrake ili elektroni. To znači da su beta-čestice ustvari elektroni velikih brzina, ali za razliku od elektrona u elektronskom omotaču atoma, nastaju iz atomske jezgre.
Za gama-čestice je utvrđeno da odgovaraju tvrdim rendgenskim zrakama. To su dokazali Rutherford i E. N. da Costa Andrade 1914., ogibom ili difrakcijom gama-čestica kroz odgovarajuću kristalnu rešetku, pomoću koje su uspijeli i odrediti i njihovu valnu duljinu. Prema dosadašnjim mjerenjima utvrđeno je da su valne duljine gama-čestica između 0,000466 nm i 0,0428 nm. Prema tome, gama-čestice odgovaraju kratkovalnom rendgenskom zračenju, ali za razliku od rendgenskog zračenja nastaju u atomskoj jezgri.
Teorija radioaktivnog raspadanja
Nikako se u to vrijeme nije moglo objasniti odakle tako velika energija kojom zrače radioaktivne tvari. Na osnovu činjenice da se atomi radioaktivnih tvari doista raspadaju i prelaze u atome drugih elemenata manje težine, tj. da se transmutiraju, Rutherford i Frederick Soddy postavili su 1903. teoriju radioaktivnog raspadanja. Prema njoj atomi radioaktivnih elemenata nisu stabilni, nego se spontano raspadaju (dezintegriraju ili transmutiraju), uz zračenje radioaktivnih čestica (alfa-čestica, beta-čestica ili gama-čestica), pri čemu prelaze u atome drugih elemenata.
Nuklearna reakcija
Teorija radioaktivnog raspadanja je vrlo značajna, jer prema njoj proizlazi da su atomi djeljivi i da mogu prelaziti u atome drugih kemijskih elemenata. Posto je prelaženje jednog kemijskog elementa moguće samo ako se promjena događa u atomskom jezgru, možemo zaključiti da je radioaktivnost u stvari raspadanje jezgre atoma nekih kemijskih elemenata. Promjena stanja atomske jezgre kod radioaktivnih elemenata se naziva nuklearna reakcija. [3]
Prema zakonu pomicanja atomi radioaktivnih elemenata koji emitiraju alfa-čestice prelaze u atome, čija je atomska masa manja za 4 atomske jedinice, a atomski broj manji za 2, tj. prelaze u atome elemenata, koji u periodnom sustavu zauzimaju položaj pomjeren za dva mjesta ulijevo, a atomi koji emitiraju beta-čestice prelaze u atome, koji uz istu atomsku masu povećavaju svoj atomski broj za 1, tj. prelaze u atome elemenata, koji u periodnom sustavu zauzimaju položaj pomjeren za jedno mjesto udesno.
Vrijeme poluraspada
1904. je Rutherford uvidio da vrijeme, u toku kojeg se raspadne polovina početne količine nekog radioaktivnog elementa, može poslužiti kao podatak o brzini njegovog raspadanja, pa je zato veličinu tog vremena uveo kao svojstvenu konstantu, koja se naziva vrijeme poluraspada. [4]
Scintilacija
1899. Becquerel je zapazio još jedno svojstvo radioaktivnog zračenja i to da izazivaju luminiscenciju kod mnogih kemijskih tvari, kao što su na primjer cinkov sulfid (ZnS), barijev platinocijanid (Ba[Pt(CN)4]x4 H2O) i dijamant. Zapaženo je pomoću mikroskopa da se luminiscentno svjetlucanje cinkovog sulfida, izazvano alfa-česticama, sastoji iz velikog broja pojedinačnih bljeskova svjetlosti. Zato što ovo kratkotrajno svjetlucanje ima sličan izgled svjetlucanju iskri, nazvano je scintilacija (lat. scintilla znači iskra). Pošto svaka alfa-čestica svojim udarom o luminiscentni zastor izaziva jednu scintilaciju ili iskru, Rutherford je predložio da je to vrlo pogodan način za brojanje radioaktivnih čestica. Na taj način je scintilacija poslužila kao prvi način za istraživanje količine alfa-čestica.
Rutherford je nastavio pokuse, te je koristio je zatvorenu posudu (koja se mogla puniti različitim plinovima) s pokretnim izvorom alfa čestica koji se mogao staviti na različite udaljenosti od zastora. Na zastoru su se uz pomoć mikroskopa motrile scintilacije - udarci čestica u zastor koji su izazivali svjetlucanje. Kad je u posudu stavio kisik broj scintilacija se smanjio zbog apsorpcije alfa čestica u sloju plina. Kad je u uređaj stavio suhi zrak javio se efekt suprotan očekivanom – broj scintilacija se povećao. Zatim je posudu napunio čistim dušikom i broj scintilacija bio je još i veći. Na osnovu mnogobrojnih pokusa zaključio je da čestice koje su prodornije, prelaze veći put i izazivaju scintilacije nastaju zbog sudara alfa čestica s atomima dušika, te da su te nove čestice atomi vodika.
Pokus s alfa-česticama i zlatnim listićem
Pokus s alfa-česticama i zlatnim listićem je bio jedan od najznačajnih pokusa u nuklearnoj fizici, jer je to bio prvi dokaz da u atomu postoji atomska jezgra. Rutherford okuplja plodan tim istraživača, među kojima su Hans Geiger, Ernest Marsden, George Hevesy, Henry Moseley, a nekoliko je godina dio tima bio i Niels Bohr.
Ključni se pokus za to otkriće dogodio 1909. kada su znanstvenici vrlo tanku zlatnu foliju izložili djelovanju alfa-čestica. Thompsonov model atoma je predviđao će alfa-čestice proći kroz tanki metalni film i raspršiti se pod određenim malim kutovima. No, na veliko je iznenađenje istraživačkoga tima ustanovljeno raspršenje i pod velikim kutovima, a neke su se helijeve jezgre od metalne folije odbile potpuno unatrag. Rutherford je to usporedio s vjerojatnošću da list papira odbije topovsku kuglu. Rezultat je pokusa vodio prema novom modelu atoma, koji je Rutherford predložio 1911.: atom se sastoji od središnjega naboja okruženoga sferičnom raspodjelom naboja suprotnoga predznaka. U početku se pretpostavljalo da su i elektroni građevne čestice atomske jezgre, pa je u modelu za atom dušika rednoga broja 7 bilo pretpostavljeno da u jezgri ima 21 česticu, i to 14 protona i 7 elektrona, a u elektronskom omotaču još 7 elektrona. Otkriće je spina i spektroskopija dušikovih jezgri, do čega je 1930. došao talijanski fizičar Franco Rasetti, pokazalo da se dušikove jezgre vladaju kao čestice cjelobrojnoga spina, tj. kao bozoni. To je bilo u potpunom neskladu s predloženim modelom dušikove jezgre s 21 nukleonom, pa je to neslaganje nazvano „dušikovom katastrofom“. No, „katastrofa“ je razriješena otkrićem neutrona, koje je 1932. objavio James Chadwick i njegova spina 1/2. Ruski je fizičar Dmitri Ivanenko predložio tada današnji model atoma prema kojem su atomski nukleoni protoni i neutroni, a ne elektroni. Naziv proton za pozitivno nabijeni nukleon prvi je upotrijebio Rutherford, a on je 1919. godine izveo i prvu pretvorbu (transmutaciju) jednoga elementa u drugi; toj je prvoj nuklearnoj reakciji u povijesti bombardirao dušik alfa-česticama i tako dobio kisik.
Rutherfordovo raspršenje
Rutherfordovo raspršenje je pojava iz nuklearne fizike, kojom se objašnjava skretanja alfa-čestica koje udaraju u tanke listiće metala, a s njim se dokazuje postojanje pozitivno nabijene atomske jezgre, koja ima gotovo svu masu atoma. Rutherfordovo raspršenje je objašnjenje strukture atomske jezgre, koje je nastalo nakon pokusa s alfa-česticama i zlatnim listićem, kojeg su izveli Ernest Rutherford, Hans Geiger i Ernest Marsden. Rezultati tog pokusa su pokazali da su skretanja alfa-čestica pod velikim kutevima bila jako rijetka, na primjer pri prolazu kroz listić platine na svakih 8000 jedna alfa-čestica bi skrenula pod kutem većim od 90º.
Rutherfordov model atoma
Činjenica koju je utvrdio Rutherford, da je alfa-čestica u stvari ion atoma helija, da je njena masa 4 puta veća od mase atoma vodika i da njen električni naboj iznosi dva elementarna električna naboja, omogućila je određivanje električnog naboja svakog atoma. Osim toga, Rutherford je zapazio još jednu važnu pojavu, da se alfa-čestice raspršuju pri prolazu kroz neki materijal, na osnovu koje je zasnovao Rutherfordov model atoma. On je zapazio da se uski snop alfa-čestica, nakon prolaza kroz tanki listić (foliju) metala, skreće od polaznog snopa i da se rasprši. Zapazio je i da se alfa-čestice više rasprše kod prolaza kroz metal, nego kod prolaza kroz zrak.
Prva nuklearna pretvorba
Godine 1919. Rutherford je, bombardirajući dušik alfa-česticama izveo prvu pretvorbu (transmutaciju) jednog elementa u drugi. Rutherford je prilikom istraživanja raspršenja alfa-čestica kroz zrak, otkrio da prilikom bombardiranja atoma dušika s alfa-česticama nastaju nove jezgre atoma kisika i vodika.
Neutron
1921. Rutherford je radio s Nielsom Bohrom i pretpostavio je postojanje neutrona, kojeg je 1932. dokazao njegov kolega James Chadwick i 1935. dobio Nobelovu nagradu za fiziku za to otkriće.
Izvori
- ↑ [1] Arhivirano 2017-07-31 na Wayback Machine-u "Od rude do žutog kolača", Nuklearna elektrana Krško, 2011.
- ↑ [2] Arhivirano 2012-01-01 na Wayback Machine-u "Povijest fizike", Ivan Supek, 2011.
- ↑ [3][mrtav link] "Uvod u nuklearnu energetiku", Prof. dr. sc. Danilo Feretić, 2011.
- ↑ [4] Arhivirano 2017-02-05 na Wayback Machine-u "4.1 FIZIKA NEK-a - Fisija", Nuklearna elektrana Krško, e-škola, 2011.
Vanjske veze

- p
- r
- u
1901. Jacobus Henricus van 't Hoff • 1902. Hermann Emil Fischer • 1903. Svante Arrhenius • 1904. William Ramsay • 1905. Adolf von Baeyer • 1906. Henri Moissan • 1907. Eduard Buchner • 1908. Ernest Rutherford • 1909. Wilhelm Ostwald • 1910. Otto Wallach • 1911. Marie Curie • 1912. Victor Grignard / Paul Sabatier • 1913. Alfred Werner • 1914. Theodore William Richards • 1915. Richard Willstätter • 1916. • 1917. • 1918. Fritz Haber • 1919. • 1920. Walther Nernst • 1921. Frederick Soddy • 1922. Francis William Aston • 1923. Fritz Pregl • 1924. • 1925. Richard Adolf Zsigmondy
1926. Theodor Svedberg • 1927. Heinrich Otto Wieland • 1928. Adolf Windaus • 1929. Arthur Harden / Hans von Euler-Chelpin • 1930. Hans Fischer • 1931. Carl Bosch / Friedrich Bergius • 1932. Irving Langmuir • 1933. • 1934. Harold Urey • 1935. Frédéric Joliot / Irène Joliot-Curie • 1936. Peter Debye • 1937. Norman Haworth / Paul Karrer • 1938. Richard Kuhn • 1939. Adolf Butenandt / Lavoslav Ružička • 1940. • 1941. • 1942. • 1943. George de Hevesy • 1944. Otto Hahn • 1945. Artturi Ilmari Virtanen • 1946. James B. Sumner / John Howard Northrop / Wendell Meredith Stanley • 1947. Robert Robinson • 1948. Arne Tiselius • 1949. William Giauque • 1950. Otto Diels / Kurt Alder
1951. Edwin McMillan / Glenn T. Seaborg • 1952. Archer Martin / Richard Laurence Millington Synge • 1953. Hermann Staudinger • 1954. Linus Pauling • 1955. Vincent du Vigneaud • 1956. Cyril Norman Hinshelwood / Nikolaj Semjonov • 1957. Lord Todd • 1958. Frederick Sanger • 1959. Jaroslav Heyrovský • 1960. Willard Libby • 1961. Melvin Calvin • 1962. Max Perutz / John Kendrew • 1963. Karl Ziegler / Giulio Natta • 1964. Dorothy Hodgkin • 1965. Robert Burns Woodward • 1966. Robert S. Mulliken • 1967. Manfred Eigen / Ronald George Wreyford Norrish / George Porter • 1968. Lars Onsager • 1969. Derek Barton / Odd Hassel • 1970. Luis Federico Leloir • 1971. Gerhard Herzberg • 1972. Christian B. Anfinsen / Stanford Moore / William Howard Steinn • 1973. Ernst Otto Fischer / Geoffrey Wilkinson • 1974. Paul J. Flory • 1975. John Warcup Cornforth / Vladimir Prelog
1976. William Lipscomb • 1977. Ilya Prigogine • 1978. Peter D. Mitchell • 1979. Herbert C. Brown / Georg Wittig • 1980. Paul Berg / Walter Gilbert / Frederick Sanger • 1981. Ken'ichi Fukui / Roald Hoffmann • 1982. Aaron Klug • 1983. Henry Taube • 1984. Robert Bruce Merrifield • 1985. Herbert A. Hauptman / Jerome Karle • 1986. Dudley R. Herschbach / Yuan T. Lee / John C. Polanyi • 1987. Donald J. Cram / Jean-Marie Lehn / Charles J. Pedersen • 1988. Johann Deisenhofer / Robert Huber / Hartmut Michel • 1989. Sidney Altman / Thomas Cech • 1990. Elias James Corey • 1991. Richard R. Ernst • 1992. Rudolph A. Marcus • 1993. Kary B. Mullis / Michael Smith • 1994. George Andrew Olah • 1995. Paul J. Crutzen / Mario J. Molina / F. Sherwood Rowland • 1996. Robert Curl / Harold Kroto / Richard Smalley • 1997. Paul D. Boyer / John E. Walker / Jens Christian Skou • 1998. Walter Kohn / John A. Pople • 1999. Ahmed Zevail • 2000. Alan J. Heeger / Alan G. MacDiarmid / Hideki Shirakawa
2001. William S. Knowles / Ryōji Noyori / K. Barry Sharpless • 2002. Kurt Wüthrich / John B. Fenn / Kōichi Tanaka • 2003. Peter Agre / Roderick MacKinnon • 2004. Aaron Tzihanover / Avram Herško / Irwin Rose • 2005. Yves Chauvin / Robert H. Grubbs / Richard R. Schrock • 2006. Roger David Kornberg • 2007. Gerhard Ertl • 2008. Osamu Shimomura / Martin Chalfie / Roger Y. Tsien • 2009. Venkatraman Ramakrišnan / Thomas A. Steitz / Ada Jonat • 2010. Richard F. Heck / Akira Suzuki / Eiichi Negishi • 2011. Dan Šehtman • 2012. Robert Lefkowitz / Brian Kobilka • 2013. Martin Karplus / Michael Levitt / Arieh Varšel • 2014. Eric Betzig / Stefan Hell / William E. Moerner • 2015. Tomas Lindahl / Paul Modrich / Aziz Sancar • 2016. Jean-Pierre Sauvage / J. Fraser Stoddart / Ben Feringa • 2017. Jacques Dubochet / Joachim Frank / Richard Henderson • 2018. Frances Arnold / Greg Winter / George P. Smith • 2019. John B. Goodenough / M. Stanley Whittingham / Akira Yoshino • 2020. Emmanuelle Charpentier / Jennifer Doudna • 2021. Benjamin List / David MacMillan • 2022. Carolyn R. Bertozzi / Morten P. Meldal / Karl Barry Sharpless • 2023. Moungi G. Bawendi / Louis E. Brus / Aleksej Jekimov






