Para

U fizici, para je supstanca u gasovitoj fazi na temperaturi nižoj od njene kritične temperature,[1] što znači da se para može kondenzovati u tečnost povećanjem pritiska bez redukovanja temperature. Para se razlikuje od aerosola.[2] Aerosol je suspenzija malih čestica tečnosti, čvrste materije, ili obe faze u gasu.[2]
Na primer, voda ima kritičnu temperaturu od 647 K (374 °C; 705 °F), što je najviša temperatura na kojoj tečna voda može da postoji. U atmosferi na normalnim temperaturama se stoga gasovita voda (poznata kao vodena para) kondenzuje u tečnost ako se njen parcijalni pritisak dovoljno poveća.
Para može da koegzistira sa tećnošću (ili sa čvrstom fazom). Kad je to slučaj, dve faze su u ravnoteži, i parcijalni pritisak gasa je jednak ravnotežnom naponu pare tečnosti (ili čvrste materije).[1]
Osobine
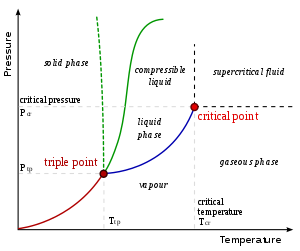
Para se odnosi na gasnu fazu pri temperaturi na kojoj data supstanca isto tako može da postoji u tečnom ili čvrstom stanju, ispod kritične temperature te substance. (Na primer, voda ima kritičnu temperaturu od 374 °C (647 K), što je najviša temperatura na kojoj tečna voda može da postoji.) Ako je para u kontaktu sa tečnom ili čvrstom fazom, dve faze će biti u stanju ravnoteže. Termin gas se odnodi na kompresibilnu fluidnu fazu. Fiksni gasovi su gasovi za koje se tečnost ili čvrsta materija ne mogu formirati na temperaturi gasa, kao što je vazduh pri tipičnim temperaturama ambijenta. Tečnost ili čvrsta materija ne moraju da ključaju da bi došlo od oslobađanja pare.
Para je odgovorna za poznate procese formiranja oblaka i kondnezaciju. Ona se često koristi za izvođenje fizičkih procesa destilacije i ekstrakcije uzorka iz prostora iznad tečnosti pre primene gasne hromatografije.
Konstitutivni molekuli pare poseduju vibraciono, rotaciono i translaciono kretanje. Ova kretanja se razmatraju u okviru kinetičke teorije gasova.
Napon pare


Napon pare je ravnotežni pritisak od tečnosti ili čvrste materije na specifičnoj temperaturi.[5][6] Na ravnotežni napon pare tečnosti ili čvrste materije ne utiče veličina kontakta sa tečnim ili čvrstim interfejsom.[7]
Normalna tačka ključanja tečnosti je temperatura na kojoj je napon pare jednak sa normalnim atmosferskim pritiskom.[1]
Za dvofazne sisteme (e.g., dve tečne faze), napon pare napon para individualnih faza je jednak. U odsustvu jačeg privlačenja imeđu sličnih ili različitih molekula, napon pare sledi Raulov zakon,[8] koji navodi da je parcijalni pritisak svake komponenta proizvod napona pare čiste komponente i njene molarne frakcije u smeši. Ukupni napon pare je suma parcijalnih pritisaka komponenti.[9][10]
Primeri

- Parfemi sadrže hemikalije koje isparavaju na različitim temperaturama i sa različitim brzinama u akordima mirisa, što je poznato kao tonovi.
- Atmosferska vodena para je prisutna u blizini zemljine površine, i može da dođe do njene kondenzacije u male kapljice tečnosti čime se formiraju meteorološki fenomeni, kao što su magla i oblaci.
- Živine sijalice i natrijumske sijalice proizvode svetlost iz atoma u pobuđenom stanju.
- Zapaljive tečnosti ne gore kad se zapale.[11] Oblak pare iznad tečnosti gori, ako je koncentracija pare između donje (LFL) i gornje zapaljive granice (UFL) zapaljive tečnosti.
- Elektronske cigarete omogućavaju korisnicima da udišu "e-likvid" aerosol/paru, umesto duvanskog dima.[2]
Merenje količine pare
Količina prisutne pare kvantifikuje pomoću parcijalnog pritiska gasa. Pare se ophode u skladu sa barometrijskom formulom u gravitacionom polju, kao što to čine i konvencionalni atmosferski gasovi.
Vidi još
- Razređivanje (jednačina)
- Isparavanje
- Henrijev zakon
- Kondenzacijski tragovi
- Ovlaživač
Reference
- ^ а б в R. H. Petrucci, W. S. Harwood, and F. G. Herring, General Chemistry, Prentice-Hall, 8th ed. 2002, p. 483–86.
- ^ а б в Cheng, T. (2014). „Chemical evaluation of electronic cigarettes”. Tobacco Control. 23 (Supplement 2): ii11—ii17. ISSN 0964-4563. PMC 3995255
 . PMID 24732157. doi:10.1136/tobaccocontrol-2013-051482.
. PMID 24732157. doi:10.1136/tobaccocontrol-2013-051482. - ^ Predel, Bruno; Hoch, Michael J. R.; Pool, Monte (2004). Phase Diagrams and Heterogeneous Equilibria: A Practical Introduction. Springer. ISBN 978-3-540-14011-5.
- ^ Papon, P.; Leblond, J.; Meijer, P. H. E. (2002). The Physics of Phase Transition : Concepts and Applications. Berlin: Springer. ISBN 978-3-540-43236-4.
- ^ Perry, R.H.; Green, D.W., ур. (1997). Perry's Chemical Engineers' Handbook (7th изд.). McGraw-Hill. ISBN 978-0-07-049841-9.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F.Geoffrey (2002). General Chemistry
 (8th изд.). Prentice Hall. стр. 484. ISBN 978-0-13-014329-7.
(8th изд.). Prentice Hall. стр. 484. ISBN 978-0-13-014329-7. - ^ Růžička, K.; Fulem, M. & Růžička, V. „Vapor Pressure of Organic Compounds. Measurement and Correlation” (PDF). Архивирано из оригинала (PDF) 26. 12. 2010. г. Приступљено 18. 10. 2009.
- ^ F.-M. Raoult (1886) " Loi générale des tensions de vapeur des dissolvants" (General law of vapor pressures of solvents), Comptes rendus, 104 : 1430–1433.
- ^ Thomas Engel and Philip Reid, Physical Chemistry, Pearson Benjamin-Cummings, 2006, p.194
- ^ Smith, J. M.; Van Ness, H. C.; Abbott, M. M. (2005), Introduction to Chemical Engineering Thermodynamics (seventh изд.), New York: McGraw-Hill, стр. 545, ISBN 978-0-07-310445-4
- ^ Ferguson, Lon H.; Janicak, Dr Christopher A. (2005). Fundamentals of Fire Protection for the Safety Professional (на језику: енглески). Government Institutes. ISBN 9781591919605.
Literatura
- Turrell, G. (1997). Gas Dynamics: Theory and Applications. John Wiley & Sons. ISBN 978-0-471-97573-1.
- White, F. (2003). Fluid Mechanics. McGraw-Hill. ISBN 978-0-07-240217-9.
- Chalmers, David; Manley, David; Wasserman, Ryan (2009). Metametaphysics: New Essays on the Foundations of Ontology. Oxford University Press. ISBN 978-0-19-954604-6.
- Gurnett, D. A.; Bhattacharjee, A. (2005). Introduction to Plasma Physics: With Space and Laboratory Applications. Cambridge, UK: Cambridge University Press. ISBN 978-0-521-36483-6.
- Scherer, K; Fichtner, H; Heber, B (2005). Space Weather: The Physics Behind a Slogan. Berlin: Springer. ISBN 978-3-540-22907-0.
- Kurzweil, Peter; Scheipers, Paul (2010). „Chemie: Grundlagen, Aufbauwissen, Anwendungen und Experimente”. Springer. ISBN 9783834803412.
- Kickelbick, Guido (2008). „Chemie für Ingenieure”. Pearson Deutschland. ISBN 978-3-8273-7267-3.
- Engels, B.; Schmuck, C.; Schirmeister, T.; Fink, R. (2008). „Chemie für Mediziner”. Pearson Deutschland. ISBN 9783827372864.
- Line, Compact Silver (2010). „Physik: Grundwissen Formeln und Gesetze”. Compact Verlag. ISBN 9783817478910.
- Meschede, Dieter; Gerthsen, Christian (2003). „Gerthsen Physik”. Springer. ISBN 9783540026228.
- J. P. Hansen, I. R. Mcdonald (2006). Theory of simple Liquids. Elsevier Academic Press. ISBN 978-0-12-370535-8.
- M. P. Allen, D.J. Tildesly (1989). Computer Simulation of Liquids. Oxford University Press. ISBN 978-0-19-855645-9.
- Anderson, John D. (1984). Fundamentals of aerodynamics. McGraw-Hill Higher Education. ISBN 978-0-07-001656-9.
- John, James (1984). Gas Dynamics. Allyn and Bacon. ISBN 978-0-205-08014-4.
- McPherson, William; Henderson, William (1917). An Elementary study of chemistry.
- Philip Hill and Carl Peterson (1992). Mechanics and Thermodynamics of Propulsion: Second Edition. Addison-Wesley. ISBN 978-0-201-14659-2.
- National Aeronautics and Space Administration (NASA). Animated Gas Lab Архивирано на сајту Wayback Machine (22. новембар 2010). Accessed February, 2008.
- Georgia State University. HyperPhysics. Accessed February, 2008.
- Antony Lewis WordWeb. Accessed February, 2008.
- Northwestern Michigan College The Gaseous State. Accessed February, 2008.
- Růžička, K.; Fulem, M.; Růžička, V. „Vapor Pressure of Organic Compounds. Measurement and Correlation” (PDF). Архивирано из оригинала (PDF) 2010-12-26. г. Приступљено 2009-10-18.
- What is the Antoine Equation? (Chemistry Department, Frostburg State University, Maryland)
- Sinnot, R.K. (2005). Chemical Engineering Design] (4th изд.). Butterworth-Heinemann. ISBN 978-0-7506-6538-4.
- Wagner, W. (1973), „New vapour pressure measurements for argon and nitrogen and a new method for establishing rational vapour pressure equations”, Cryogenics, 13 (8), Bibcode:1973Cryo...13..470W, doi:10.1016/0011-2275(73)90003-9
- Dreisbach, R. R.; Spencer, R. S. (1949). „Infinite Points of Cox Chart Families and dt/dP Values at any Pressure”. Industrial and Engineering Chemistry. 41 (1). doi:10.1021/ie50469a040.
- Moller B.; Rarey J.; Ramjugernath D. (2008). „Estimation of the vapour pressure of non-electrolyte organic compounds via group contributions and group interactions”. Journal of Molecular Liquids. 143. doi:10.1016/j.molliq.2008.04.020.
- Krieger, Ulrich K.; Siegrist, Franziska; Marcolli, Claudia; Emanuelsson, Eva U.; Gøbel, Freya M.; Bilde, Merete (8. 1. 2018). „A reference data set for validating vapor pressure measurement techniques: homologous series of polyethylene glycols” (PDF). Atmospheric Measurement Techniques. Copernicus Publications. 11 (1). Bibcode:2018AMT....11...49K. ISSN 1867-1381. S2CID 41910898. doi:10.5194/amt-11-49-2018. Архивирано (PDF) из оригинала 2022-10-09. г. Приступљено 7. 4. 2022. CS1 одржавање: Формат датума (веза)
- Pankow, J. F.; et al. (2008). „SIMPOL.1: a simple group contribution method for predicting vapor pressures and enthalpies of vaporization of multifunctional organic compounds”. Atmos. Chem. Phys. 8 (10). Bibcode:2008ACP.....8.2773P. doi:10.5194/acp-8-2773-2008
 .
. - „Vapour pressure of Pure Liquid Organic Compounds: Estimation by EVAPORATION”. Tropospheric Chemistry Modelling at BIRA-IASB. 11. 6. 2014. Архивирано из оригинала 20. 11. 2018. г. Приступљено 2018-11-26. CS1 одржавање: Формат датума (веза)
- Compernolle, S.; et al. (2011). „EVAPORATION: a new vapour pressure estimation method for organic molecules including non-additivity and intramolecular interactions”. Atmos. Chem. Phys. 11 (18). Bibcode:2011ACP....11.9431C. doi:10.5194/acp-11-9431-2011
 .
. - American Meteorological Society (2012). „vapor pressure”. Glossary of Meteorology. Приступљено 2022-11-28.
- American Meteorological Society (2020). „saturation vapor pressure”. Glossary of Meteorology. Приступљено 2022-11-28.
- American Meteorological Society (2012). „equilibrium vapor pressure”. Glossary of Meteorology. Приступљено 2022-11-28.
- Raymond, David J. (2011-05-12). „Chapter 5: Cloud Microphysics” (PDF). Atmospheric Convection. New Mexico Institute of Mining and Technology. Архивирано (PDF) из оригинала 2017-03-29. г. Приступљено 2022-11-28.
- Babin, Steven M. (1998). „Relative Humidity & Saturation Vapor Pressure: A Brief Tutorial”. Johns Hopkins University Applied Physics Laboratory. Архивирано из оригинала 1998-07-13. г. Приступљено 2022-11-28.
Spoljašnje veze

- Short videos demonstrating of States of Matter, solids, liquids and gases by Prof. J M Murrell, University of Sussex











