Enllaç C-In
Els compostos d'organoindi (o compostos orgànics de l'indi) són compostos químics que contenen un enllaç químic entre carboni (C) i indi (In) (enllaç C-In). La química de l'organoindi és la ciència corresponent que explora les propietats, l'estructura i la reactivitat d'aquests compostos
La principal aplicació de la química d'organoindi és la preparació de components semiconductors per a aplicacions microelectròniques. L'àrea també té un cert interès en la síntesi orgànica. La majoria dels compostos d'organoindi presenten l'estat d'oxidació In(III), semblant als seus congèneres més lleugers Ga(III) i B(III).[1]
Organoindi(I)
L'indi monovalent és relativament més comú que el Ga(I) o el B(I). Un exemple és el ciclopentadienilindi(I)
-
![Estructura del CpIn, que és un polímer (vermell = In).[2]](//upload.wikimedia.org/wikipedia/commons/thumb/b/b8/InCp-chain-3D-balls.png/981px-InCp-chain-3D-balls.png) Estructura del CpIn, que és un polímer (vermell = In).[2]
Estructura del CpIn, que és un polímer (vermell = In).[2]
-
![Estructura de [InC(tms)₃]₄, en In(I) tetraedranè (gris fosc = In).[3]](//upload.wikimedia.org/wikipedia/commons/thumb/e/ec/YUZZOI.svg/498px-YUZZOI.svg.png) Estructura de [InC(tms)₃]₄, en In(I) tetraedranè (gris fosc = In).[3]
Estructura de [InC(tms)₃]₄, en In(I) tetraedranè (gris fosc = In).[3]
Organoindi(III)
El trimetilindi és un sòlid incolor i volàtil. És la font preferida d'indi per a la deposició de vapor mitjançant processos químics organometàl·lics (MOVPE) de semiconductors compostos que contenen indi (com ara InP, InAs, AlInGaNP, etc...). InMe₃ és pirofòric.
-
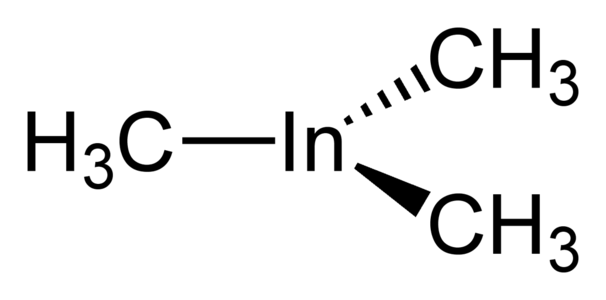 Trimetilindi
Trimetilindi
Per obtenir els derivats de trialquil, és típica l'alquilació de trihalurs d'indi amb reactius d'organoliti.[4]
Els compostos d'organoindi(III) també es preparen tractant indi metàl·lic amb halogenurs d'alquil. Aquesta reacció dóna halogenurs d'organoindi barrejats. Il·lustrativa és la reacció del bromur d'alil amb una suspensió de THF d'indi. Es produeixen tant dibromur de monoalilindi com bromur de dialilindi.[5]
Es creu que una varietat d'espècies d'organoindi III) com InRX3− i solvats de RXIn+, R₂In+ i X₂In+ s'interconverteixen ràpidament a temperatura ambient.[6]
Al·lilacions mediades per indi (IMA)
Les al·lilacions mediades per indi (IMA) procedeixen en dos passos: en primer lloc, l'indi reacciona amb l'halogenur d'al·lil, dóna un intermedi alil-In(III); en segon lloc, aquest indi reacciona amb un electròfil.
La reacció es duu a terme en les condicions d'una reacció de Barbier on l'indi, l'halogenur d'al·lil i l'electròfil es barregen en el mateix procès. L'indi s'alquila més fàcilment que altres metalls (com Mg, Pb, Bi o Zn) i no requereix promotor ni dissolvent orgànic. Els IMA tenen avantatges sobre altres reaccions de formació d'enllaços de carboni a causa de la seva capacitat per dur-se a terme a l'aigua (vegeu Química verda).[7][8]
Tot i que les al·lilacions mediades per l'indi (IMA) es poden dur a terme en medis aquosos, es poden utilitzar una varietat d'altres dissolvents, com ara THF (tetrahidrofurà), DMF (dimetilformamida), líquids iònics a temperatura ambient, NMF (n-metilformamida) i altres.[9][10] El dissolvent sovint afecta la solubilitat, la velocitat de la reacció, el rendiment, l'estabilitat, la regioselectivitat i l'estereoselectivitat. L'indi media l'al·lilació d'una gran varietat d'electròfils.
Els exemples de l'esquema següent il·lustren l'amplitud d'aplicacions de l'IMA:
-
 Varietats de reaccions d'IMA
Varietats de reaccions d'IMA
Selectivitat
Els intermedis organoindi no reaccionen amb els grups –OH o –CO₂H. Però les reaccions amb carbonils donen rendiments elevats. La investigació ha demostrat que en les reaccions d'un intermedi indi amb un compost electròfil tant d'aldehid com de cetona, la reacció va procedir amb l'aldehid.[11]
La regioselectivitat de l'al·lilació mediada per l'indi en aigua depèn dels efectes estèrics dels substituents tant en l'intermedi com en el carbonil. Un atac α del nucleòfil (a la posició que porta l'halogen) es pot distingir d'un atac γ (al doble enllaç) mitjançant la inspecció dels productes. Aquesta regioselectivitat no sembla dependre de la conjugació o del grau de substitució.[12]
L'addició de reactius d'al·lilindi als aldehids substituïts en carbonis α o β pot ser molt diastereoselectiva en sistemes aquosos. Per exemple, si el control de la quelació està present en un aldehid α-oxi, s'espera que el producte sigui el diastereòmer syn.
Nombroses investigacions han trobat una explicació a aquest efecte. Els oxígens del grup carbonil i hidroxil quelen l'indi de l'intermedi organoindi. L'incipient enllaç C-C crea un anell de sis membres en una conformació de cadira. Sota el control de la quelació, el grup al·lil ataca el carboni carbonílic des del costat menys obstaculitzat oposat al del grup R. Una vegada que l'enllaç C-C està totalment format, l'indi s'allibera, produint el syn diol. Una estructura quelata similar és rellevant per a l'al·lació dels aldehids β-oxi com a resultat d'antidiols.[13][14]
S'ha informat que l'addició de reactius d'al·lilindi a hidrazines electròfiles, il·lustrades a continuació, sintetitza només un enantiòmer del producte quiral amb una selectivitat de fins a un 97% utilitzant binol com a additiu quiral.[15] De la mateixa manera, un aminoalcohol quiral permet una enantioselectivitat extremadament alta en l'al·lilació de cetones.[16]
L'al·lació en aigua mediada per indi és especialment útil en la síntesi d'hidrats de carboni (com els àcids siàlics), sense utilitzar grups protectors.[17]
Referències
- ↑ Shen et al., Loh, p. 271-401.
- ↑ Beachley et al., Fettinger, p. 1051-1059.
- ↑ Uhl et al., 1995, p. C1-C5.
- ↑ Kopasz, Hallock i Beachley, 1986, p. 89-91.
- ↑ Yasuda, M; Haga, M; Nagaoka, Y; Baba, A. Eur. J. Org. Chem. 2010, p. 5359-5363 (anglès)
- ↑ Koszinowski, K. J. Am. Chem. Soc. 2010, 132, p. 6032–6040 (anglès)
- ↑ Li i Chan, 1991, p. 7017-7020.
- ↑ Li i Chan, 1999, p. 11149-11176.
- ↑ Frimpong, K; Wzorek, J; Lawlor, C; Spencer, K; Mitzel. T; J. Org. Chem. 2009, 74, p. 5861-5870. doi:10.1021/jo900763u (anglès)
- ↑ Law, M.C; Cheung, T.W; Wong, K.Y; Chan, T.H.; J. Org. Chem. 2007, 72, p. 923-929 (anglès)
- ↑ Haddad, T.D; Hirayama, L.C; Buckley, J.J; Singaram, B. J. Org. Chem. 2012, 77, p. 889-898 (anglès)
- ↑ Isaac, M.B; Chan, T.H. Tetrahedron Lett. 1995, 36, p. 8957-8960 (anglès)
- ↑ Paquette, L.A; Mitzel, T.M. J. Am. Chem. Soc. 1996, 118, p. 1931-1937 (anglès)
- ↑ «Allylindation in Aqueous Media: Methyl 3-(Hydroxymethyl)-4-Methyl-2-Methylenepentanoate». Organic Syntheses, 77, 2000, pàg. 107. DOI: 10.15227/orgsyn.077.0107.
- ↑ Cook, G.R; Kargbo, R; Maity, B. Org. Lett. 2005, 7, p. 2767-2770 (anglès)
- ↑ Haddad, T.D; Hirayama, L.C; Taynton, P; Singaram, B. Tetrahedron Lett. 2008, 49, p. 508-511 (anglès)
- ↑ Chan i Li, 1992, p. 747-748.
Bibliografia
- Beachley, O. T.; Pazik, J. C.; Glassman, T. E.; Churchill, M. R.; Fettinger, J.C.; Blom, R. «Synthesis, characterization and structural studies of In(C₅H₄Me) by x-ray diffraction and electron diffraction techniques and a reinvestigation of the crystalline state of In(C₅H₅) by x-ray diffraction studies» (en anglès). Organometallics, 7, 1988. DOI: 10.1021/om00095a007.
- Chan, T. H.; Li, C. J. «A Concise Chemical Synthesis of (+) 3-Deoxy-D-glycero-D-galacto-nonulsonic acid (KDN)» (en anglès). J. Chem. Soc., Chem. Commun, 1992. DOI: 10.1039/C39920000747.
- Kopasz, J. P.; Hallock, R. B.; Beachley, O. T. «Tris[(Trimethylsilyl)Methyl]Indium» (en anglès). Inorganic Syntheses, 24, 1986. DOI: 10.1002/9780470132555.ch27.
- Li, C. J.; Chan, T. H. «Organic Reactions in Aqueous Media with Indium» (en anglès). Tetrahedron Lett., 32, 1991. DOI: 10.1016/0040-4039(91)85028-4.
- Li, C. J.; Chan, T. H. «Organic Syntheses Using Indium-Mediated and Catalyzed Reactions In Aqueous Media» (en anglès). Tetrahedron, 55, 1999. DOI: 10.1016/S0040-4020(99)00641-9.
- Shen, Zhi-Liang; Wang, Shun-Yi; Chok, Yew-Keong; Xu, Yun-He; Loh, Teck-Peng «Organoindium Reagents: The Preparation and Application in Organic Synthesis» (en anglès). Chemical Reviews, 113, 2013, pàg. 271–401. DOI: 10.1021/cr300051y. PMID: 23110495.
- Uhl, Werner; Graupner, Rene; Layh, Marcus; Schütz, Uwe «In4{C(SiMe3)3}4 mit In4-tetraeder und In4Se4{C(SiMe3)3}4 mit In4Se4-heterocubanstruktur» (en alemany). J. Chem. Soc., 493, 1995. DOI: 10.1016/0022-328X(95)05399-A.
Vegeu també
- Al·lilació Krische
![Estructura del CpIn, que és un polímer (vermell = In).[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b8/InCp-chain-3D-balls.png/981px-InCp-chain-3D-balls.png)
![Estructura de [InC(tms)₃]₄, en In(I) tetraedranè (gris fosc = In).[3]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ec/YUZZOI.svg/498px-YUZZOI.svg.png)




