Enllaç C-Sn
Els compostos d'organoestany (o compostos orgànics de l'estany) són compostos químics que contenen un enllaç químic entre carboni (C) i estany (Sn) (enllaç C-Sn).
La química de l'organoestany és la ciència corresponent que explora les propietats, l'estructura i la reactivitat d'aquests compostos. El primer compost d'organoestany va ser el diiodur de dietilestany ((C₂H5)₂SnI₂), descobert per Edward Frankland el 1849.[1] L'àrea va créixer ràpidament a la dècada del 1900, especialment després del descobriment dels reactius de Grignard, que són útils per produir enllaços Sn-C. L'àrea continua sent rica amb moltes aplicacions a la indústria i activitat continuada al laboratori d'investigació.[2]
Estructura
Els compostos d'organoestany generalment es classifiquen segons els seus estats d'oxidació. Els compostos d'estany(IV) són molt més comuns i més útils.
Derivats orgànics de l'estany(IV)
Els derivats del tetraorganoestany són invariablement tetraèdrics. Els compostos del tipus SnRR'R''R''' s'han resolt en enantiòmers individuals.[3]
Halurs d'organoestany
Els clorurs d'organoestany tenen la fórmula R4−nSnCln per a valors de n fins a 3. També es coneixen bromurs, iodurs i fluorurs, però menys importants. Aquests compostos són coneguts per a molts grups R. Sempre són tetraèdrics. Els trihalurs i dihalurs formen aductes amb bones bases de Lewis com la piridina. Els fluorurs tendeixen a associar-se de manera que el difluorur de dimetilestany forma polímers semblants a làmines. Els halogenurs de diorganoestany i especialment de triorganoestany (per exemple, el clorur de tributilestany), presenten toxicitats properes a les del cianur d'hidrogen.[4]
Hidrurs d'organoestany
Els hidrurs d'organoestany tenen la fórmula R4−nSnHn per a valors de n fins a 4. El membre principal d'aquesta sèrie, l'estanyà (SnH4), és un gas incolor inestable. L'estabilitat es correlaciona amb el nombre de substituents orgànics. L'hidrur de tributilestany s'utilitza com a font de radical hidrur en algunes reaccions orgàniques.
Òxids i hidròxids d'organoestany
Els òxids i hidròxids d'organoestany són productes habituals de la hidròlisi dels halogenurs d'organoestany. A diferència dels derivats corresponents de silici i germani, els òxids i hidròxids d'estany sovint adopten estructures amb centres d'estany pentacoordinats i fins i tot hexacoordinats, especialment per als derivats diorgànics i monoorganics. El grup Sn-O-Sn s'anomena estanyoxà. Estructuralment més simples dels òxids i hidròxids són els derivats del triorganoestany. Un hidròxid de triorganoestany important comercialment és l'acaricida Cyhexatin (també anomenat Plictran), (C6H11)₃SnOH. Aquests hidròxids de triorganoestany existeixen en equilibri amb els distanoxans:
- 2 R₃SnOH
 R₃SnOSnR₃ + H₂O
R₃SnOSnR₃ + H₂O
Amb només dos substituents orgànics a cada centre de Sn, els òxids i hidròxids de diorganoestany són estructuralment més complexos que els derivats de triorganoestany.[5] Es desconeixen els diols geminals simples (R₂Sn(OH)₂) i les estanyones monomèriques (R₂Sn=O). Els òxids de diorganoestany (R₂SnO) són polímers excepte quan els substituents orgànics són molt voluminosos, en aquest cas els trímers cíclics o, en el cas dels dímers R = CH(SiMe₃)₂, amb anells Sn₃O₃ i Sn₂O₂. Els diestanyoxans existeixen com a dímers de dímers amb la fórmula [R₂SnX]₂O₂ on els grups X (per exemple, clorur, hidròxid, carboxilat) poden ser terminals o pont (vegeu la taula).
-
 Estructura idealitzada de l'òxid de diorganoestany trimèric
Estructura idealitzada de l'òxid de diorganoestany trimèric -
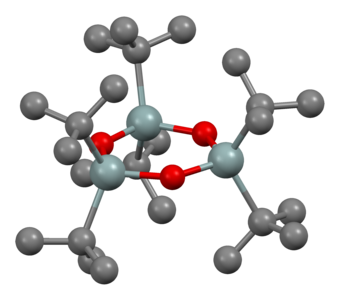 Model de barres i boles per (t-Bu₂SnO)₃.
Model de barres i boles per (t-Bu₂SnO)₃. -
 Estructura de l'òxid de diorganoestany, destacant l'extens enllaç intermolecular.
Estructura de l'òxid de diorganoestany, destacant l'extens enllaç intermolecular.
La hidròlisi dels trihalurs de monoorganoestany té el potencial de generar àcids estanyoics, RSnO2. Pel que fa als òxids/hidròxids de diorganoestany, les espècies de monoorganoestany es formen estructuralment complexes a causa de l'aparició de deshidratació/hidratació, agregació. És il·lustrativa la hidròlisi del triclorur de butilestany per donar [(BuSn)12O14(OH)6]2+.
Estanyats hipercoordinats
A diferència dels anàlegs de carboni(IV), però una mica com els compostos de silici, l'estany(IV) també es pot coordinar amb cinc i fins i tot sis àtoms en lloc dels quatre normals. Aquests compostos hipercoordinats solen tenir substituents electronegatius. Els òxids d'organoestany i els carboxilats associats i els derivats pseudohalurs relacionats proporcionen nombrosos exemples d'hipervalència[5] (com els halogenurs d'organoestany per a aductes, per exemple Me₂SnCl₂ (bipiridina)).
Fins i tot s'han caracteritzat els pentaorganoestanyats i hexaorganoestanyats totalment orgànics,[6] mentre que l'any següent es va informar d'un compost de tetraorganoestany de sis complexos coordinats.[7] Es va informar d'una estructura cristal·lina de pentaorganoestany de carboni estable a temperatura ambient (en argó) com a sal de liti amb aquesta estructura:[8]
-
 Pentaorganoestany
Pentaorganoestany
En aquesta estructura bipiramidal trigonal distorsionada, les longituds dels enllaços de carboni a estany (2,26 Å apical, 2,17 Å equatorial) són més grans que els enllaços C-Sn regulars (2,14 Å) reflectint la seva naturalesa hipercoordinada.
Cations triorganoestany
Algunes reaccions dels halogenurs de triorganoestany impliquen un paper per als intermedis R₃Sn+. Aquests cations són anàlegs als carbocations. S'han caracteritzat cristal·logràficament quan els substituents orgànics són grans, com el 2,4,6-triisopropilfenil.
Radicals d'estany (derivats orgànics de l'estany(III))
Els radicals d'estany, amb la fórmula R₃Sn, s'anomenen radicals estanyil.[2] S'invoquen com a intermedis en determinades reaccions de transferència d'àtoms. Per exemple, l'hidrur de tributilestany (tri-n-butilstanyà) serveix com a font útil d'àtoms d'hidrogen a causa de l'estabilitat del radical tributiestany.[9]
Derivats orgànics de l'estany(II)
Els compostos d'organoestany(II) són una mica rars. Els compostos amb la fórmula empírica SnR₂ són una mica fràgils i existeixen com a anells o polímers quan R no és voluminós. Els polímers, anomenats poliestanyans, tenen la fórmula (SnR₂)n.
-
 Poliestanyà
Poliestanyà
En principi, es podria esperar que els compostos d'estany divalents formin anàlegs d'alquens amb un doble enllaç formal. De fet, els compostos amb la fórmula Sn₂R4, anomenats diestanyans, són coneguts per certs substituents orgànics. Els centres Sn solen ser molt piramidals. Els compostos monomèrics amb la fórmula SnR₂, anàlegs de carbens, també es coneixen en alguns casos. Un exemple és Sn(SiR₃)₂, on R és el CH(SiMe₃)₂ molt voluminós (Me = metil). Aquestes espècies es dimereixen de manera reversible al disestanyilè després de la cristal·lització:
- 2 R₂Sn
 (R₂Sn)₂
(R₂Sn)₂
Els estanyens, compostos amb dobles enllaços estany-carboni, s'exemplifican amb els derivats de l'estanybenzè. Els estanyols, anàlegs estructurals del ciclopentadiè, presenten poc caràcter d'enllaç doble C-Sn.
Derivats orgànics de l'estany (I)
Els compostos de Sn(I) són rars i només s'observen amb lligands molt voluminosos. S'accedeix a una família destacada de gàbies mitjançant la piròlisi del 2,6-dietilfenil substituït amb triestanyil·lè [Sn(C6H₃-2,6-Et₂)₂]₃, que proporciona el clúster de tipus cubà i un prismà. Aquestes gàbies contenen Sn(I) i tenen la fórmula [Sn(C6H₃-2,6-Et₂)]n on n = 8, 10.[10]
-
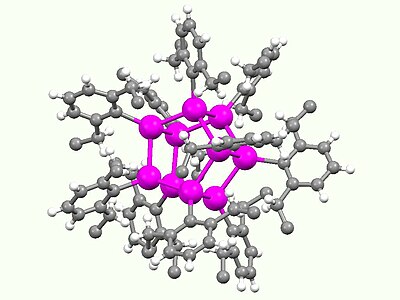 Estructura d'un «prismà» Ar10Sn10, un compost que conté Sn(I) (Ar = 2,6-dietilfenil)
Estructura d'un «prismà» Ar10Sn10, un compost que conté Sn(I) (Ar = 2,6-dietilfenil)
Un estanyí conté un triple enllaç C-Sn, i un diestanyí un triple enllaç entre dos àtoms d'estany (RSnSnR). Els diestanyins només existeixen per a substituents extremadament voluminosos. A diferència dels alquins, el nucli C-Sn-Sn-C d'aquests diestanyins no és lineal, tot i que són plans. La distància Sn-Sn és de 3,066(1) Å, i els angles Sn-Sn-C és 99,25(14)°. Aquests compostos es preparen mitjançant la reducció d'halogenurs d'arilestany(II) voluminosos.[11]
Preparació
Els compostos d'organoestany es poden sintetitzar mitjançant nombrosos mètodes.[12] Clàssic és la reacció d'un reactiu de Grignard amb halogenurs d'estany, per exemple, el tetraclorur d'estany. Un exemple el proporciona la síntesi de tetraetilestany:[13]
- 4 EtMgBr + SnCl4 → Et4Sn + 4 MgClBr
Els compostos simètrics de tetraorganoestany, especialment els derivats de tetraalquil, es poden convertir després en diversos clorurs barrejats mitjançant reaccions de redistribució (també conegudes com a «comproporcionació de Kocheshkov» en el cas dels compostos d'organoestany):
- 3 R4Sn + SnCl4 → 4 R₃SnCl
- R4Sn + SnCl4 → 2 R₂SnCl₂
- R4Sn + 3 SnCl4 → 4 RSnCl₃
Un mètode relacionat implica la redistribució d'halogenurs d'estany amb compostos d'organoalumini.
Els compostos d'estany d'organo-halur barrejats es poden convertir en derivats orgànics mixts, tal com s'il·lustra amb la síntesi de dibutildivinilestany:[14]
- Bu₂SnCl₂ + 2 C₂H₃MgBr → Bu₂Sn(C₂H₃)₂ + 2 MgBrCl
Els hidrurs d'organoestany es generen per reducció dels clorurs d'alquil mixtos. Per exemple, el tractament del diclorur de dibutilestany amb hidrur de liti i alumini dóna el dihidrur de dibutilestany, un oli destil·lable incolor:[15]
La síntesi orgànica de tributil-[(Z)-5-fenil-2-penten-2-il]è:[Nota 1][16]
-
 Síntesi de compostos d'organoestany
Síntesi de compostos d'organoestany
L'acoblament semblant a Wurtz de compostos alquilsòdics amb halogenurs d'estany produeix compostos de tetraorganoestany.
La hidroestanyil·lació implica l'addició catalitzada per metalls d'hidrurs d'estany a través de substrats insaturats.[17]
Reaccions
Les reaccions importants, comentades anteriorment, solen centrar-se en halogenurs d'organoestany i pseudohalurs amb nucleòfils. En l'àrea de la síntesi orgànica, es considera important la reacció d'Stille. Implica una reacció d'acoblament amb halogenurs orgànics hibridats amb sp2 catalitzats per pal·ladi:
i addicions d'organoestanyans (addició nucleòfila d'un alil-, al·lenil- o propargilestanyans a aldehids i imines). Els compostos d'organoestany també s'utilitzen àmpliament en la química dels radical (per exemple, ciclitzacions de radicals, desoxigenació de Barton-McCombie, descarboxilació de Barton, etc.).
Aplicacions
Un compost d'organoestany s'aplica comercialment com a estabilitzador en clorur de polivinil. En aquesta capacitat, suprimeixen la degradació eliminant els grups clorur al·lílic i absorbint el clorur d'hidrogen. Aquesta aplicació consumeix unes 20.000 tones d'estany cada any.[2]
La classe principal de compostos organoestanys són els ditiolats de diorganoestany amb la fórmula R₂Sn(SR')₂. L'enllaç Sn-S és el component reactiu.[2]
Els carboxilats de diorganoestany, per exemple, el dilaurat de dibutilestany, s'utilitzen com a catalitzadors per a la formació de poliuretans, per a la vulcanització de silicones i la transesterificació.[2]
El triclorur de n-butilestany s'utilitza en la producció de capes de diòxid d'estany en ampolles de vidre per deposició química de vapor.
Aplicacions biològiques
Els «tributilestanys» s'utilitzen com a biocides industrials (per exemple, com a agents antifúngics en tèxtils i paper, sistemes de fàbrica de pasta de fusta i paper, cerveseries i sistemes de refrigeració industrials). Els derivats de trifenilestany s'utilitzen com a components actius de pintures antifúngiques i fungicides agrícoles. Altres triorganoestanys s'utilitzen com a acaricides. L'òxid de tributilestany s'ha utilitzat àmpliament com a conservant de la fusta.[2]
Els compostos de tributilestany es van utilitzar una vegada àmpliament com a agents antibioincrustació marina per millorar l'eficiència dels vaixells oceànics. Les preocupacions sobre la toxicitat[18] d'aquests compostos (alguns informes descriuen efectes biològics sobre la vida marina a una concentració d'1 nanogram per litre) van provocar una prohibició mundial per part de l'Organització Marítima Internacional. Com a compostos antiincrustants, els compostos organoestanys han estat substituïts per diclorooctilisotiazolinona.[19]
| Compostos d'organoestany | ||
|---|---|---|
| Fórmula | Nom | Descripció i aplicacions |
 | Tetrabutilestany | Un oli incolor, precursor dels altres compostos de butilestany. |
 | Òxid de tributilestany | Un líquid incolor a groc pàl·lid utilitzat en la conservació de la fusta. |
 | Acetat de trifenilestany | Un sòlid cristal·lí blanquinós, utilitzat com a insecticida i fungicida. |
 | Clorur de trifeniestany | Un sòlid blanc altament tòxic, utilitzat com a biocida. |
 | Clorur de trimetilestany | Un sòlid blanc tòxic, que es va utilitzar com a biocida. |
 | Hidròxid de trifenilestany | Una pols blanquinosa, utilitzada com a fungicida. |
 | Azocicloestany | Un sòlid blanc, utilitzat com a acaricida d'acció prolongada per al control dels àcars de les plantes. |
 | Cyhexaestany | Un sòlid blanc, utilitzat com a acaricida. |
 | Hexametildiestany | Utilitzat com a intermedi en la síntesi química. |
 | Tetraetilestany | Amb el punt d'ebullició a 63–65 °/12 mm s'utilitza com a un catalitzador. |
Toxicitat
Les toxicitats dels compostos derivats de tributilestany i trifenilestany són comparables a les del cianur d'hidrogen. A més, els tri-n-alquilestanys són fitotòxics i, per tant, no es poden utilitzar en agricultura. Segons els grups orgànics, poden ser bactericides i fungicides potents. Com a reflex de la seva alta bioactivitat, els «tributilestanys» es van utilitzar una vegada en la pintura antiincrustant marina.[2]
En contrast amb els compostos de triorganoestany, els compostos monoorganoestany, diorganoestany i tetraorganoestany són molt menys perillosos.[4]
Tanmateix, l'òxid de dibutilestany (DBT) pot ser immunotòxic.[20]
Notes
- ↑ El reactiu de Grignard es prepara a partir de tornejos de magnesi i (Z)-2-bromo-5-fenil-2-pentè en tetrahidrofurà sec i es valora amb clorur de tributilestany fins que la solució es decolori. La solució resultant s'agita a temperatura ambient durant 1 hora i s'elimina el dissolvent en un evaporador rotatiu. S'afegeix èter dietílic i l'extracte d'èter es renta amb salmorra i es filtra, i l'èter s'evapora en un evaporador rotatiu. El producte cru es destila en un kugelrohr per produir tributil-[(Z)-5-fenil-2-pentè-2-il]estanyà com un oli incolor.
Referències
- ↑ Casery, 2014, p. 20-24.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Davies, 2004.
- ↑ Gielen, 1973, p. 198-202.
- ↑ 4,0 4,1 G. G. Graf. Ullmann's Encyclopedia of Industrial Chemistry (en anglès). Weinheim, Alemanya: Wiley-VCH, 2005. DOI 10.1002/14356007.a27_049.
- ↑ 5,0 5,1 Chandrasekhar, Nagendran i Baskar, 2002, p. 1-52.
- ↑ Reich i Phillips, 1986, p. 2102-2103.
- ↑ Das et al., 1987, p. 10-14.
- ↑ Saito et al., Nagase, p. 10974-10975.
- ↑ RajanBabu, Page i Buckley, 2004.
- ↑ Sita, 1994, p. 191-197.
- ↑ Power, 2007, p. 4362-4372.
- ↑ Thoonen, Deelman i Koten, 2004, p. 2145-2157.
- ↑ Der Kerk i Luijten, 1956, p. 86ff.
- ↑ Seyferth, 1959, p. 10.
- ↑ Eisch, 1981.
- ↑ Stoermer i Pinhey, 1998, p. M67.
- ↑ Smith, Mancuso i Lautens, 2000, p. 3257-3282.
- ↑ Gajda i Jancso, 2010, p. 111-151.
- ↑ Silva et al., Borges, p. 991.
- ↑ Gumy, 2008, p. e3545.
Bibliografia
- Caseri, Walter «Initial Organotin Chemistry» (en anglès). Journal of Organometallic Chemistry, 751, 2014. DOI: 10.1016/j.jorganchem.2013.08.009.
- Chandrasekhar, Vadapalli; Nagendran, Selvarajan; Baskar, Viswanathan «Organotin assemblies containing Sn/O bonds» (en anglès). Coordination Chemistry Reviews, 235, 2002. DOI: 10.1016/S0010-8545(02)00178-9.
- Das, V. G. Kumar; Mun, Lo Kong; Wei, Chen; Mak, Thomas C. W. «Synthesis, Spectroscopic Study, and X-ray Crystal Structure of Bis[3-(2-pyridyl)-2-thienyl-C,N]diphenyltin(IV): The First Example of a Six-Coordinate Tetraorganotin Compound» (en anglès). Organometallics, 6, 1987. DOI: 10.1021/om00144a003.
- Davies, Alwyn George. Organotin Chemistry (en anglès). Weinheim: Wiley-VCH, 2004. ISBN 978-3-527-31023-4.
- Der Kerk, G. J. M. van; Luijten, J. G. A. «Tetraethyltin» (en anglès). Org. Synth., 36, 1956. DOI: 10.15227/orgsyn.036.0086.
- Eisch, John. Organometallic Syntheses: Nontransition-Metal Compounds (en anglès). Nova York: Ed. Academic Press, 1981. ISBN 0122349504.
- Gajda, M.; Jancso, A. Organotins, Formation, Use, Speciation and Toxicology (en anglès). vol 7. Organometallics in environment and toxicology. Cambridge: RSC publishing, 2010 (Metal Ions in Life Sciences). DOI 10.1039/9781849730822-00111. ISBN 9781847551771.
- Gielen, Marcel «From kinetics to the synthesis of chiral tetraorganotin compounds» (en anglès). Acc. Chem. Res., 6(6), 1973. DOI: 10.1021/ar50066a004.
- Gumy, C. «Dibutyltin Disrupts Glucocorticoid Receptor Function and Impairs Glucocorticoid-Induced Suppression of Cytokine Production» (en anglès). PLOS ONE, 3(10), 2008. Bibcode: 2008PLoSO...3.3545G. DOI: 10.1371/journal.pone.0003545. PMC: 2568824. PMID: 18958157.
- Power, Philip P. «Bonding and Reactivity of Heavier Group 14 Element Alkyne Analogues» (en anglès). Organometallics, 26(18), 2007. DOI: 10.1021/om700365p.
- RajanBabu, T. V.; Page, P. C. B.; Buckley, B. R.. «Tri-n-butylstannane». A: e-EROS Encyclopedia of Reagents for Organic Synthesis (en anglès), 2004. DOI 10.1002/047084289X.rt181.pub2.
- Reich, Hans J.; Phillips, Nancy H. «Lithium-Metalloid Exchange Reactions. Observation of Lithium Pentaalkyl/aryl Tin Ate Complexes» (en anglès). J. Am. Chem. Soc., 108(8), 1986, pàg. 2102–2103. DOI: 10.1021/ja00268a067.
- Saito, Masaichi; Imaizumi, Sanae; Tajima, Tomoyuki; Ishimura, Kazuya; Nagase, Shigeru «Synthesis and Structure of Pentaorganostannate Having Five Carbon Substituents» (en anglès). J. Am. Chem. Soc., 129(36), 2007. DOI: 10.1021/ja072478+. PMID: 17705378.
- Seyferth, Dietmar «Di-n-butyldivinyltin» (en anglès). Org. Synth., 39, 1959. DOI: 10.15227/orgsyn.039.0010.
- Silva, Vânia; Silva, Cátia; Soares, Pedro; Garrido, E. Manuela; Borges, Fernanda; Garrido, Jorge «Isothiazolinone Biocides: Chemistry, Biological, and Toxicity Profiles» (en anglès). Molecules, 25(4), 2020. DOI: 10.3390/molecules25040991. PMC: 7070760. PMID: 32102175.
- Sita, Lawrence R. «Heavy-Metal Organic Chemistry: Building with Tin» (en anglès). Acc. Chem. Res., 27(7), 1994. DOI: 10.1021/ar00043a002.
- Smith, Nicholas D.; Mancuso, John; Lautens, Mark «Metal-Catalyzed Hydrostannations» (en anglès). Chemical Reviews, 100(8), 2000. DOI: 10.1021/cr9902695. PMID: 11749320.
- Stoermer, Martin J.; Pinhey, John T. «Tributyl-[(Z)-5-phenyl-2-penten-2-yl]stannane» (en anglès). Molecules, 3, 1998. DOI: 10.3390/m67.
- Thoonen, Sander H. L.; Deelman, Berth-Jan; Koten, Gerard van «Synthetic aspects of tetraorganotins and organotin(IV) halides» (
 PDF) (en anglès). Journal of Organometallic Chemistry, 689, 2004.
PDF) (en anglès). Journal of Organometallic Chemistry, 689, 2004.
Enllaços externs
- «National Pollutant Inventory Fact Sheet for organotins» (en anglès). Arxivat de l'original el 2006-04-11. [Consulta: 25 desembre 2022].
- «Industry information site» (en anglès). Ortepa. Arxivat de l'original el 2007-01-18. [Consulta: 25 desembre 2022].
- «Organotin chemistry in synthesis» (en anglès).









![Stille reaction scheme {\displaystyle {\ce {{R-X}+ R'-SnR''3 ->[{\ce {catalitzador\ Pd\ }}] {R-R'}+ XSnR''3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/500c2e31eca671ff6c466edccc6dded23ab17b8e)


