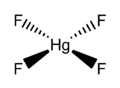
Fluorek rtęci(IV)
 | Ten artykuł od 2017-04 zawiera treści, przy których brakuje odnośników do źródeł. Należy dodać przypisy do treści niemających odnośników do źródeł. Dodanie listy źródeł bibliograficznych jest problematyczne, ponieważ nie wiadomo, które treści one uźródławiają. Sprawdź w źródłach: Encyklopedia PWN • Google Books • Google Scholar • Federacja Bibliotek Cyfrowych • BazHum • BazTech • RCIN • Internet Archive (texts / inlibrary) Dokładniejsze informacje o tym, co należy poprawić, być może znajdują się w dyskusji tego artykułu. Po wyeliminowaniu niedoskonałości należy usunąć szablon {{Dopracować}} z tego artykułu. |
| |||||||||||||||
| |||||||||||||||
| Ogólne informacje | |||||||||||||||
| Wzór sumaryczny | HgF | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 276,58 g/mol | ||||||||||||||
| |||||||||||||||
| Podobne związki | |||||||||||||||
| Podobne związki | tetrafluorek siarki, fluorek uranu(IV) | ||||||||||||||
| |||||||||||||||
Fluorek rtęci(IV) (tetrafluorek rtęci), HgF
4 – nieorganiczny związek chemiczny z grupy fluorków, sól kwasu fluorowodorowego i rtęci na IV stopniu utlenienia, pierwszy znany związek rtęci(IV).
Rtęć, podobnie jak inne pierwiastki grupy 12 układu okresowego (cynk i kadm), ma konfigurację elektronową s2d10 i zasadniczo tworzy wiązania z użyciem orbitalu s. Oznacza to, że najwyższy typowy stopień utlenienia rtęci w związkach wynosi II. Z tego powodu nierzadko prowadzi się spory co do słuszności zaliczania cynkowców do metali przejściowych.
Rozważania nad wyższymi stopniami utlenienia rtęci pojawiły się w latach siedemdziesiątych XX wieku, zaś przeprowadzone dwadzieścia lat później obliczenia wykazały, że związki rtęci(IV) o konfiguracji d8 i geometrii płaskokwadratowej mogą być trwałe w fazie gazowej. Doświadczalnie istnienie tego typu połączeń potwierdzono w 2007 roku, otrzymując HgF
4 na matrycy ze stałego neonu i argonu w temperaturze 4 K. Związek wykryto za pomocą spektroskopii w podczerwieni. Analiza w ramach między innymi teorii funkcjonału gęstości wskazuje, że w tworzenie wiązań zaangażowane są orbitale d. Rtęć zachowuje się więc tu jak typowy pierwiastek przejściowy. Niemniej, za W.B. Jensenem można powiedzieć, że warunki, w jakich istnieje HgF
4 daleko odbiegają od typowych warunków równowagowych i połączenie to powinno być traktowane raczej jako wyjątek.
Badania teoretyczne sugerują, że nietypowa w grupie 12 zdolność rtęci do tworzenia tetrafluorku wynika z relatywistycznej mechaniki kwantowej. Z obliczeń wynika, że dla „mniej relatywistycznych” (lżejszych) pierwiastków tej grupy, cynku i kadmu, tetrafluorki byłyby skrajnie niestabilne i rozpadałyby się do difluorków z eliminacją cząsteczki F
2. Z drugiej strony, tetrafluorek koperniku, powinien być stabilniejszy niż rtęci, lecz doświadczalne potwierdzenie takiej ewentualności spotyka się z problemem krótkiego czasu życia samego pierwiastka.
Bibliografia
- XuefangX. Wang XuefangX. i inni, Mercury Is a Transition Metal: The First Experimental Evidence for HgF4, „Angewandte Chememie International Edition”, 46 (44), 2007, s. 8371–8375, DOI: 10.1002/anie.200703710 .
- Elusive Hg(IV) species has been synthesized under cryogenic conditions [online], European Virtual Institute for Speciation Analysis, 12 października 2007 [dostęp 2012-06-14] .
- SebastianS. Riedel SebastianS., High Oxidation States: Mercury tetrafluoride synthesized [online], Psichem.de [dostęp 2012-06-14] .
- William B.W.B. Jensen William B.W.B., Is Mercury Now a Transition Element?, „Journal of Chemical Education”, 85, 2008, s. 1182–1183, DOI: 10.1021/ed085p1182 .
- p
- d
- e
| 1. Wodoru i litowców | |
|---|---|
| 2. Berylowców |
|
| 3. Skandowców |
|
| Lantanowców |
|
| Aktynowców |
|
| 4. Tytanowców |
|
| 5. Wanadowców |
|
| 6. Chromowców |
|
| 7. Manganowców |
|
| 8. Żelazowców |
|
| 9. Kobaltowców |
|
| 10. Niklowców |
|
| 11. Miedziowców |
|
| 12. Cynkowców |
|
| 13. Borowców |
|
| 14. Węglowców |
|
| 15. Azotowców |
|
| 16. Tlenowców |
|
| 17. Fluorowców |
|
| 18. Helowców |
|