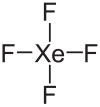Tetrafluorek ksenonu
| |||||||||||||||||||||||
 kryształy czterofluorku ksenonu | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny | XeF4 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 207,29 g/mol | ||||||||||||||||||||||
| Wygląd | bezbarwne kryształy[1] | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | 13709-61-0 | ||||||||||||||||||||||
| PubChem | 123324 | ||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
| |||||||||||||||||||||||
Tetrafluorek ksenonu (nazwa Stocka: fluorek ksenonu(IV)), XeF4 – nieorganiczny związek chemiczny z grupy fluorków.
Był pierwszym otrzymanym związkiem chemicznym gazu szlachetnego z dokładnie jednym innym pierwiastkiem. Powstaje w wyniku reakcji ksenonu z fluorem[3]:
- Xe + 2F2 → XeF4
Tworzy bezbarwne kryształy, które sublimują w temperaturze 115,7 °C.
W warunkach normalnych jest stabilny. Pod wpływem wody ulega hydrolizie, w wyniku której w reakcji dysproporcjonowania powstaje m.in. tritlenek ksenonu i ksenon.
- 3XeF4 + 6H2O → XeO3 + 2Xe + 1,5H2O + 12HF
Przypisy
- ↑ a b c d e f David R.D.R. Lide David R.D.R. (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-98, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b David R.D.R. Lide David R.D.R. (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 6-53, ISBN 978-1-4200-9084-0 (ang.).
- ↑ H.H. Claassen, H. Selig, J.G. Malm. Xenon Tetrafluoride. „J. Am. Chem. Soc.”. 84 (18), s. 3593, 1962. DOI: 10.1021/ja00877a042. (ang.).
Bibliografia
- K. Wieczffiński: Gazy szlachetne: zarys technologii i własności chemiczne. Warszawa: Wydawnictwa Naukowo-Techniczne, 1968.
Linki zewnętrzne
- Xenon compounds: xenon tetrafluoride. WebElements. [dostęp 2012-10-07]. (ang.).
- p
- d
- e
| 1. Wodoru i litowców | |
|---|---|
| 2. Berylowców |
|
| 3. Skandowców |
|
| Lantanowców |
|
| Aktynowców |
|
| 4. Tytanowców |
|
| 5. Wanadowców |
|
| 6. Chromowców |
|
| 7. Manganowców |
|
| 8. Żelazowców |
|
| 9. Kobaltowców |
|
| 10. Niklowców |
|
| 11. Miedziowców |
|
| 12. Cynkowców |
|
| 13. Borowców |
|
| 14. Węglowców |
|
| 15. Azotowców |
|
| 16. Tlenowców |
|
| 17. Fluorowców |
|
| 18. Helowców |
|
- Britannica: science/xenon-tetrafluoride