Fluorid rtutičitý
| Fluorid rtutičitý | |
|---|---|
 Strukturní vzorec | |
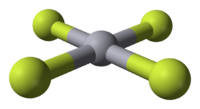 Model molekuly | |
| Obecné | |
| Systematický název | fluorid rtutičitý |
| Sumární vzorec | HgF4 |
| Identifikace | |
| Registrační číslo CAS | 149625-19-4 |
| PubChem | 165365641 |
| SMILES | [F-].[F-].[F-].[F-].[Hg] |
| InChI | 1S/4FH.Hg/h4*1H;/q;;;;+4/p-4 |
| Vlastnosti | |
| Molární hmotnost | 276,58 g/mol |
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). Některá data mohou pocházet z datové položky. | |
Fluorid rtutičitý, HgF4, je první popsaná sloučenina obsahující rtuť v oxidačním čísle +4. Rtuť má, podobně jako ostatní prvky 12. skupiny (kadmium a zinek), elektronovou konfiguraci d10s2 a do vazeb obvykle zapojuje pouze orbital 6s; nejvyšší běžné oxidační číslo rtuti je tak +2, a z tohoto důvodu bývá mnohdy řazena mezi postpřechodné kovy namísto přechodných. HgF4 byl poprvé popsán v experimentech z roku 2007, ale jeho existence je sporná; experimenty provedené roku 2008 nedokázaly tuto sloučeninu zachytit znovu.[1]
Historie
Myšlenky o možných vyšších oxidačních číslech rtuti se objevovaly od 70. let 20. století, a teoretické výpočty v 90. letech ukázaly, že by látka v plynném skupenství měla být stálá, se čtvercově rovinnou geometrií (odpovídající konfiguraci d8). Experimentální důkazy byly ale získány až v roce 2007, kdy byl HgF4 připraven s využitím matricové izolace v pevném neonu a argonu za teploty 4 K. Identifikace sloučeniny byla provedena pomocí infračervené spektroskopie.[2][3]
Výpočty na základě teorie funkcionálu hustoty bylo zjištěno, že orbitaly d se na vazbách podílí a rtuť by tak měla být řazena k přechodným kovům (ke kterým se kovy 12. skupiny někdy nezapočítávají, protože nevytváří vyšší oxidační čísla než +2).[4] William B. Jensen ale poukázal na skutečnost, že HgF4 existuje pouze za nerovnovážných podmínek a měl by být považován za výjimku.[5]
Vysvětlení
Teoretické studie naznačují, že by rtuť na rozdíl od lehčích prvků 12. skupiny, zinku a kadmia, mohla v důsledku relativistických efektů dosahovat oxidačního čísla +4 a vytvářet tak molekulu se čtyřmi fluoridovými anionty, Odpovídající sloučeniny zinku a kadmia, u kterých jsou relativistické efekty slabší, jsou nestálé a rychle se rozkládají na fluor, F2, a fluorid dvojmocného kovu. Podle předpovědí by měl být odpovídající fluorid dalšího prvku 12. skupiny, kopernicia (CnF4), ještě stálejší.[6]
Novější studie označily existenci HgF4 i CnF4 za nepravděpodobnou.[7]
Příprava a vlastnosti
HgF4 se připravuje reakcí rtuti a fluoru:
- Hg + 2 F2 → HgF4
Látka je stabilní pouze při matricové izolaci za teploty 4 K; zahřátím nebo při vzájemném kontaktu molekul HgF4 se rozkládá na HgF2 a F2:
- HgF4 → HgF2 + F2
HgF4 by měl být diamagnetický. Atom rtuti má elektronovou konfiguraci 6s25d86p6, čímž dodržuje oktetové pravidlo, ale ne pravidlo 18 elektronů. Molekula je izoelektronická s tetrafluorzlatitanovým aniontem, AuF -
4 .
Reference
V tomto článku byl použit překlad textu z článku Mercury(IV) fluoride na anglické Wikipedii.
- ↑ Is mercury a transition metal?. www2.hull.ac.uk [online]. [cit. 2023-10-20]. Dostupné v archivu pořízeném z originálu dne 2016-10-12.
- ↑ High Oxidation States: Mercury tetrafluoride synthesized [online]. [cit. 2023-10-20]. Dostupné v archivu pořízeném dne 2011-07-19.
- ↑ Elusive Hg(IV) species has been synthesized under cryogenic conditions [online]. 2007-10-12. Dostupné online.
- ↑ Xuefang Wang; Lester Andrews; Sebastian Riedel; Martin Kaupp. Mercury Is a Transition Metal: The First Experimental Evidence for HgF4. Angewandte Chemie International Edition. 2007, s. 8371–8375. DOI 10.1002/anie.200703710. PMID 17899620.
- ↑ William B. Jensen. Mercury Is a Transition Metal: The First Experimental Evidence for HgF4. Journal of Chemical Education. 2008, s. 1182–1183. DOI 10.1021/ed085p1182. Bibcode 2008JChEd..85.1182J.
- ↑ Darleane C. Hoffman; Diana M. Lee; Valeria Pershina. The Chemistry of the Actinide and Transactinide Elements. Příprava vydání Norman M. Edelstein, Jean Fuger. Dordrecht: Springer Science+Business Media, 2006. ISBN 1-4020-3555-1. Kapitola Transactinides and the future elements.
- ↑ J. Brändas; Eugene S. Kryachko. Fundamental World of Quantum Chemistry: A Tribute to the Memory of Per-Olov Löwdin. [s.l.]: Springer, 2013-03-09. ISBN 9789401704489.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid rtutičitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid rtutičitý na Wikimedia Commons










