Fluorid titaničitý
| Fluorid titaničitý | |
|---|---|
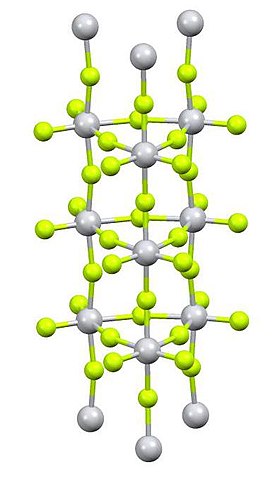 Struktura | |
| Obecné | |
| Systematický název | fluorid titaničitý |
| Sumární vzorec | TiF4 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 7783-63-3 |
| PubChem | 121824 |
| SMILES | F[Ti](F)(F)F |
| InChI | 1S/4FH.Ti/h4*1H;/q;;;;+4/p-4 |
| Vlastnosti | |
| Molární hmotnost | 123,86 g/mol |
| Teplota tání | 377 °C (650 K) |
| Teplota varu | sublimuje |
| Hustota | 2,798 g/cm3 |
| Bezpečnost | |
 GHS05  GHS07 Nebezpečí[1] | |
Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). Některá data mohou pocházet z datové položky. | |
Fluorid titaničitý je anorganická sloučenina se vzorcem TiF4. Tato bílá hygroskopická pevná látka zaujímá na rozdíl od ostatních titaničitých halogenidů polymerní strukturu. Podobně jako u dalších tetrahalogenidů jde o silnou Lewisovu kyselinu.
Příprava, struktura a reakce
TiF4 se nejčastěji připravuje reakcí chloridu titaničitého s přebytkem fluorovodíku:
- TiCl4 + 4 HF → TiF4 + 4 HCl
Přečišťování se provádí sublimací, při které dochází ke zvratnému štěpení polymerní struktury.[2]
Rentgenovou krystalografií bylo zjištěno, že Ti centra jsou oktaedrická, ovšem propojena do neobvyklého sloucovitého uspořádání.[3]
TiF4 se vytváří komplexy s mnoha různými ligandy; příkladem může být sloučenina cis-TiF4(MeCN)2, jež vzniká reakcí s acetonitrilem.[4]
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid titaničitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid titaničitý na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Titanium tetrafluoride na anglické Wikipedii.
- ↑ a b Titanium tetrafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 200.
- ↑ H. Bialowons; M. Mueller; B. G. Mueller. Titantetrafluorid - Eine Überraschend einfache Kolumnarstruktur. Zeitschrift für Anorganische und Allgemeine Chemie. 1995, s. 1227–1231. DOI 10.1002/zaac.19956210720.
- ↑ Grigory Nikiforov; Herbert W. Roesky; Debasis Koley. A survey of titanium fluoride complexes, their preparation, reactivity, and applications. Coordination Chemistry Reviews. 2014, s. 16–57. DOI 10.1016/j.ccr.2013.09.002.









