Kyselina glutarová
| Kyselina glutarová | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | kyselina pentandiová |
| Triviální název | kyselina glutarová |
| Latinský název | acidum glutaricum |
| Anglický název | glutaric acid n-pyrotartaric acid |
| Německý název | Glutarsäure |
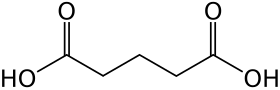
| Funkční vzorec | HOOC(CH2)3COOH |
| Sumární vzorec | C5H8O4 |
| Identifikace | |
| Registrační číslo CAS | 110-94-1 |
| PubChem | 743 |
| SMILES | C(CC(=O)O)CC(=O)O |
| InChI | InChI=1S/C5H8O4/c6-4(7)2-1-3-5(8)9/h1-3H2,(H,6,7)(H,8,9) |
| Vlastnosti | |
| Molární hmotnost | 132,12 g/mol |
| Teplota tání | 95–98 °C |
| Teplota varu | 200 °C (20 mmHg) |
| Rozpustnost ve vodě | koncentrace nasyceného roztoku přes 50 % při pokojové teplotě |
| Bezpečnost | |
 GHS05 Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Kyselina glutarová je jedna z mnoha karboxylových kyselin, v jejichž rámci se řadí mezi dikarboxylové kyseliny. Její vzorec je HOOC(CH2)3COOH. Její systematický název zní kyselina pentandiová. Ačkoliv jsou podobné „lineární“ dikarboxylové kyseliny, jako jsou například kyselina adipová a jantarová, poměrně obtížně rozpustné ve vodě (koncentrace nasycených roztoků je jen několik procent), kyselina glutarová je velmi dobře rozpustná (koncentrace nasyceného roztoku přes 50 % při pokojové teplotě).
Příprava
Kyselina glutarová se připravuje reakcí butyrolaktonu s kyanidem draselným.[2]
Také se může připravit reakcí dibrompropanu s kyanidem sodným nebo draselným za vzniku dinitrilu, následovanou hydrolýzou.
Biochemie
Kyselina glutarová se v živých organismech přirozeně vytváří během metabolismu některých aminokyselin, včetně lysinu a tryptofanu. Defekty v této metabolické cestě mohou vést k poruše nazývané glutarová acidurie (GA). Typ I (GA I) patří mezi organické acidurie a je způsoben neschopností organismu zpracovávat aminokyseliny lysin a tryptofan kvůli deficitu glutaryl-CoA dehydrogenázy. Dochází pak k hromadění toxických vedlejších produktů, které mohou způsobit těžkou encefalopatii (globální dysfunkce mozku).
Použití
1,5-pentandiol, běžný plastifikátor a prekurzor polyesterů, se vyrábí hydrogenací kyseliny glutarové a jejich derivátů.[3]
Tato kyselina byla také používána na výrobu polymerů, například polyesterových polyolů.
Bezpečnost
Kyselina glutarová může způsobit podráždění sliznic, kůže a očí. Akutní nebezpečí nastává při vdechnutí nebo absorpci kůží.
Reference
V tomto článku byl použit překlad textu z článku Glutaric acid na anglické Wikipedii.
- ↑ a b Glutaric acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ OrgSynth | author = G. Paris, L. Berlinguet, R. Gaudry, J. English, Jr. and J. E. Dayan | title = Glutaric Acid and Glutaramide | collvol = 4 | collvolpages = 496 | year = 1963 | prep = cv4p0496
- ↑ Peter Werle and Marcus Morawietz "Alcohols, Polyhydric" in Ullmann's Encyclopedia of Industrial Chemistry: 2002, Wiley-VCH: Weinheim. DOI 10.1002/14356007.a01_305
Externí odkazy
 Obrázky, zvuky či videa k tématu kyselina glutarová na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina glutarová na Wikimedia Commons
| Dikarboxylové kyseliny | |
|---|---|
| dikarboxylové nasycené kyseliny | Kyselina šťavelová (COOH)2 • Kyselina malonová (COOHCH2COOH) • Kyselina jantarová (COOH(CH2)2COOH) • Kyselina oxaloctová (COOHCO(CH2)COOH) • Kyselina glutarová (COOH(CH2)3COOH) • Kyselina adipová (COOH(CH2)4COOH) • Kyselina pimelová (COOH(CH2)5COOH) • Kyselina suberová (COOH(CH2)6COOH) • Kyselina azelaová (COOH(CH2)7COOH) • Kyselina sebaková (COOH(CH2)8COOH) |
| nenasycené dikarboxylové kyseliny | |
| aromatické dikarboxylové kyseliny | Kyselina ftalová (C6H4(COOH)2) • Kyselina isoftalová (C6H4(COOH)2) • Kyselina tereftalová (C6H4(COOH)2) |
| též trikarboxylové kyseliny | Kyselina akonitová (HO2CCH=C(CO2H)CH2CO2H) • Kyselina hemimellitová (C6H3(COOH)3) • Kyselina trimellitová (C6H3(COOH)3) • Kyselina trimesinová (C6H3(COOH)3) |
| Monokarboxylové kyseliny • Hydroxykyseliny | |









